题目内容
[化学选修-有机化学基础]
烷烃A只可能有三种一氯取代产物B、C和D.C分子中碳、氢的百分含量分别为C%=59.75%、H%=10.79%.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.C在强碱的醇溶液中不能反应.以上反应及B的进一步反应如图所示.
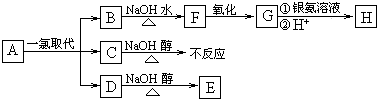
请回答:
(1)C的分子式为 .
(2)B转变为F的反应属于 反应(填反应类型名称),D转变为E的反应属于 反应(填反应类型名称).
(3 )F和H反应的化学方程式为: .
(4)G物质同分异构体中属于醛类的有 种(不包括本身).
烷烃A只可能有三种一氯取代产物B、C和D.C分子中碳、氢的百分含量分别为C%=59.75%、H%=10.79%.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.C在强碱的醇溶液中不能反应.以上反应及B的进一步反应如图所示.

请回答:
(1)C的分子式为
(2)B转变为F的反应属于
(3 )F和H反应的化学方程式为:
(4)G物质同分异构体中属于醛类的有
考点:有机物的推断
专题:有机物的化学性质及推断
分析:烷烃A只可能有三种一氯取代产物B、C和D.C分子中碳、氢的百分含量分别为C%=59.75%、H%=10.79%,则C分子中N(C):N(H):N(Cl)=
:
:
=6:13:1,由烷烃烃基组成通式可知,C的分子式为C6H13Cl,则A的分子式为C6H14,C在强碱的醇溶液中不能反应,则氯原子相连的相邻碳原子上没有氢原子,B和D分别与强碱的醇溶液共热,都只能得到有机化合物,可推知A为(CH3)3CCH2CH3,C为ClCH2C(CH3)2CH2CH3,B、D分别为(CH3)3CCH2CH2Cl、(CH3)3CCHClCH3中的一种,E为(CH3)3CCH=CH2,B水得到的F为醇,可以连续氧化,故B为(CH3)3CCH2CH2Cl、D为(CH3)3CCHClCH3,F为(CH3)3CCH2CH2OH,G为(CH3)3CCH2CHO,H为(CH3)3CCH2COOH,据此解答.
| 59.75% |
| 12 |
| 10.79% |
| 1 |
| 1-59.75%-10.79% |
| 35.5 |
解答:
解:烷烃A只可能有三种一氯取代产物B、C和D.C分子中碳、氢的百分含量分别为C%=59.75%、H%=10.79%,则C分子中N(C):N(H):N(Cl)=
:
:
=6:13:1,由烷烃烃基组成通式可知,C的分子式为C6H13Cl,则A的分子式为C6H14,C在强碱的醇溶液中不能反应,则氯原子相连的相邻碳原子上没有氢原子,B和D分别与强碱的醇溶液共热,都只能得到有机化合物,可推知A为(CH3)3CCH2CH3,C为ClCH2C(CH3)2CH2CH3,B、D分别为(CH3)3CCH2CH2Cl、(CH3)3CCHClCH3中的一种,E为(CH3)3CCH=CH2,B水得到的F为醇,可以连续氧化,故B为(CH3)3CCH2CH2Cl、D为(CH3)3CCHClCH3,F为(CH3)3CCH2CH2OH,G为(CH3)3CCH2CHO,H为(CH3)3CCH2COOH,
(1)由上述分析可知,C的分子式为:C6H13Cl,故答案为:C6H13Cl;
(2)B转变为F是(CH3)3CCH2CH2Cl发生水解反应生成(CH3)3CCH2CH2OH,水解反应属于取代反应,D转变为E是(CH3)3CCHClCH3发生消去反应生成(CH3)3CCH=CH2,故答案为:取代反应;消去反应;
(3 )F和H反应的化学方程式为 ,
,
故答案为: ;
;
(4)G[(CH3)3CCH2CHO]物质同分异构体中属于醛类,可以看做戊烷中一个H原子被-CHO取代,正戊烷有3种H原子,取代可以形成3种醛,异戊烷有4种H原子,取代可以形成3种醛,其中正戊烷的2号碳原子上的取代与异戊烷4号碳原子上的取代产物相同,新戊烷有1种H原子,取代可以形成1种醛(为G的结构),故不含G的结构,符合条件的同分异构体共有3+4-1=6,故答案为:6.
| 59.75% |
| 12 |
| 10.79% |
| 1 |
| 1-59.75%-10.79% |
| 35.5 |
(1)由上述分析可知,C的分子式为:C6H13Cl,故答案为:C6H13Cl;
(2)B转变为F是(CH3)3CCH2CH2Cl发生水解反应生成(CH3)3CCH2CH2OH,水解反应属于取代反应,D转变为E是(CH3)3CCHClCH3发生消去反应生成(CH3)3CCH=CH2,故答案为:取代反应;消去反应;
(3 )F和H反应的化学方程式为
 ,
,故答案为:
 ;
;(4)G[(CH3)3CCH2CHO]物质同分异构体中属于醛类,可以看做戊烷中一个H原子被-CHO取代,正戊烷有3种H原子,取代可以形成3种醛,异戊烷有4种H原子,取代可以形成3种醛,其中正戊烷的2号碳原子上的取代与异戊烷4号碳原子上的取代产物相同,新戊烷有1种H原子,取代可以形成1种醛(为G的结构),故不含G的结构,符合条件的同分异构体共有3+4-1=6,故答案为:6.
点评:本题考查有机物推断、有机反应类型、同分异构体等,计算确定C的分子式是关键,再结合转化关系推断,难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
对于溶液中某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
下列有关工业生产的叙述正确的是( )
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、氯碱工业中,使用离子交换膜可防止Cl2和NaOH溶液反应 |
| C、硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量 |
| D、硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响 |
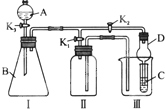 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题: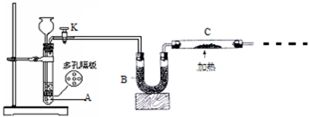 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.