题目内容
 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
Al和FeO发生铝热反应的热化学方程式是
某同学认为,铝热反应可用于工业炼铁,你的判断是
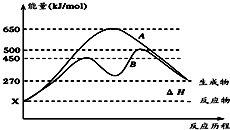
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂.
考点:用盖斯定律进行有关反应热的计算,化学反应速率的影响因素
专题:化学反应中的能量变化,化学反应速率专题
分析:(1)根据盖斯定律,利用加合法,②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H,该反应需要引发,成本过高;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度,化学反应速率加快,据此解答;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂.
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度,化学反应速率加快,据此解答;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂.
解答:
解:(1)①Fe(s)+
O2(g)═FeO(s)△H1=-272.0kJ?mol-1;
②2Al(s)+
O2(g)═Al2O3(s)△H2=-1675.7kJ?mol-1.
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-1675.7kJ?mol-1-(3×-272.0kJ?mol-1)=-859.7 kJ?mol-1,
铝热反应需要镁燃烧引发,消耗较多能量,成分过高,因此不能用于工业炼铁,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能,该反应为引发反应,需要消耗大量的能量,成本较高;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度,化学反应速率加快,因此逆反应速率增大,
故答案为:吸;增大;
②由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率,
故答案为:D.
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-1675.7kJ?mol-1-(3×-272.0kJ?mol-1)=-859.7 kJ?mol-1,
铝热反应需要镁燃烧引发,消耗较多能量,成分过高,因此不能用于工业炼铁,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能,该反应为引发反应,需要消耗大量的能量,成本较高;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度,化学反应速率加快,因此逆反应速率增大,
故答案为:吸;增大;
②由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率,
故答案为:D.
点评:本题考查了反应热的计算、化学反应能量变化图象分析判断,反应活化能和焓变的理解应用,掌握盖斯定律的计算、化学平衡是关键,题目难度中等.

练习册系列答案
相关题目
下列物质属于纯净物的是( )
| A、空气 |
| B、盐酸 |
| C、洁净的食盐水 |
| D、CuSO4?5H2O |
化学无处不在,与化学有关的说法正确的是( )
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |

 和
和
 和
和
 (环戊烷)
(环戊烷)
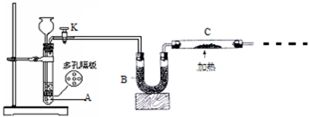 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.