题目内容
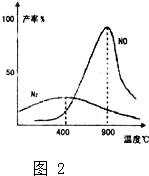
 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.①图1中能够表示NO2的浓度变化曲线是
②能说明该反应已达到平衡状态的是
a.v消耗(NO)=v生成(NO2)
b.容器内混合气体的密度保持不变
c.容器内混合气体的平均相对分子质置保持不变
d.容器内c(NO):c(O2)保持不变
e.容器内氧气体积分数保持不变
(2)在一定体积的密闭容器中有反应CO2(g)+H2(g)?CO(g)+H2O(g).
①某温度下,该反应平衡时浓度关系为3c(CO2).c(H2)=5c(CO).c(H2O),则此时的平衡常数K=
②830℃时,其平衡常数K=l.向该容器中加入1LCO2与1LH2,达到平衡时CO的体积分数是
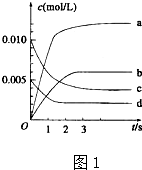
(3)氨气和氧气从145℃就开始反应,在不同温度和催化荆条件下生成不同产物(如图2):
4NH3+5O24?4NO+6H2O,4NH3+3O2?2N2+6H2O温度较低时以生成
(4)向体积为2L的固定密闭容器中通入3molX气体,在一定强度下发生如下反应:2X(g)?Y(g)+3Z(g),经5min后反应达到平衡,此对测得容器内的压强为起始时的1.2倍:若保持温度和体积不变,起始时加X、Y、Z物质的量分别为amol、bmol、cmol,当达到平衡时仍与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据反应方程式2NO(g)+O2(g)?2N02可知,反应无论完全从左边还是右边反应,生成物的物质的量不可能超过反应物,所以曲线a是错误的,然后根据曲线bcd的变化判断能够表示NO2的浓度变化曲线;
②若该反应达到了平衡状态,则一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化,据此进行判断;
(2)①根据平衡常数的表达式及3c(CO2).c(H2)=5c(CO).c(H2O)计算出该反应在该温度下的平衡常数;
②设达到平衡时消耗二氧化碳的体积为x,列出化学平衡的三段式,根据平衡常数K=1计算出x,然后计算出平衡时CO的体积分数;
(3)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降;
(4)根据等效平衡,起始时维持化学反应向逆反应方向进行,说明c的数值大于达到平衡时Z的浓度,据此进行分析.
②若该反应达到了平衡状态,则一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化,据此进行判断;
(2)①根据平衡常数的表达式及3c(CO2).c(H2)=5c(CO).c(H2O)计算出该反应在该温度下的平衡常数;
②设达到平衡时消耗二氧化碳的体积为x,列出化学平衡的三段式,根据平衡常数K=1计算出x,然后计算出平衡时CO的体积分数;
(3)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降;
(4)根据等效平衡,起始时维持化学反应向逆反应方向进行,说明c的数值大于达到平衡时Z的浓度,据此进行分析.
解答:
解:(1)①根据反应2NO(g)+O2(g)?2N02可知,图象中曲线a一定不满足可逆反应特点,即曲线a不能表示NO、O2和N02,则bcd表示的是该可逆反应中物质的量变化,由于c、d曲线中表示的物质的物质的量都减小,b曲线物质的量从0开始,直至达到最大,说明c、d为反应物,b为生成物N02,
故答案为:b;
②a.v消耗(NO)=v生成(NO2):表示的都是正反应速率,无法判断正逆反应速率是否相等,故a错误;
b.容器内混合气体的密度保持不变:该反应中气体的体积不变、质量不变,根据ρ=
可知,气体的密度始终不变,故b错误;
c.该反应是气体体积缩小的反应,反应达到平衡状态前气体的物质的量始终不变,则气体的平均摩尔质量也发生变化,当容器内混合气体的平均相对分子质量保持不变时,说明达到了平衡状态,故c正确;
d.容器内c(NO):c(O2)保持不变,当加入的NO和氧气的物质的量为2:1时,无论是否达到平衡状态,二者浓度之比始终不变,无法判断是否达到平衡状态,故d错误;
e.容器内氧气体积分数保持不变,说明各组分的浓度不再变化,该反应达到了平衡状态,故e正确;
故答案为:ce;
(2)①在一定体积的密闭容器中有反应CO2(g)+H2(g)?CO(g)+H2O(g),该反应的平衡常数为:K=
,
某温度下,该反应平衡时浓度关系为3c(CO2).c(H2)=5c(CO).c(H2O),则该反应的平衡常数K=
=
=0.6,
故答案为:0.6;
②设达到平衡时CO2的体积消耗了xL,则:
H2(g)+CO2(g)?CO(g)+H2O(g)
开始L):1 1 0 0
变化(L):x x x x
平衡(L):1-x 1-x x x
K=
=1,
解得x=0.5,
达到平衡时生成CO的体积为0.5L,
该反应前后气体总体积不变,所以反应后气体体积仍然为2L,
所以达到平衡时CO的体积分数为:
×100%=20%,
故答案为:20%;
(3)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,
故答案为:N2;氨气氧化生成NO的反应是放热反应,升高温度转化率下降;
(4)容器内的压强与气体的物质的量成正比,容器内的压强为起始时的1.2倍,反应后的气体物质的量为:3mol×1.2mol=3.6mol,增加了0.6mol,
根据反应方程式,利用物质的量差计算:2X(g)?Y(g)+3Z(g) 物质的量变化△n
2 1 3 2
0.3mol 0.9mol 0.6mol
容器容积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与原平衡等效,且起始时维持化学反应向逆反应方向进行,说明生成物Z浓度大于达到平衡时0.9mol;
将3molX气体按照化学计量数全部转化为Z,c有最大值,最大值为4.5mol,所以c的范围为:0.9<c≤4.5,
故答案为:0.9<c≤4.5.
故答案为:b;
②a.v消耗(NO)=v生成(NO2):表示的都是正反应速率,无法判断正逆反应速率是否相等,故a错误;
b.容器内混合气体的密度保持不变:该反应中气体的体积不变、质量不变,根据ρ=
| m |
| V |
c.该反应是气体体积缩小的反应,反应达到平衡状态前气体的物质的量始终不变,则气体的平均摩尔质量也发生变化,当容器内混合气体的平均相对分子质量保持不变时,说明达到了平衡状态,故c正确;
d.容器内c(NO):c(O2)保持不变,当加入的NO和氧气的物质的量为2:1时,无论是否达到平衡状态,二者浓度之比始终不变,无法判断是否达到平衡状态,故d错误;
e.容器内氧气体积分数保持不变,说明各组分的浓度不再变化,该反应达到了平衡状态,故e正确;
故答案为:ce;
(2)①在一定体积的密闭容器中有反应CO2(g)+H2(g)?CO(g)+H2O(g),该反应的平衡常数为:K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2O) |
某温度下,该反应平衡时浓度关系为3c(CO2).c(H2)=5c(CO).c(H2O),则该反应的平衡常数K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2O) |
| 3 |
| 5 |
故答案为:0.6;
②设达到平衡时CO2的体积消耗了xL,则:
H2(g)+CO2(g)?CO(g)+H2O(g)
开始L):1 1 0 0
变化(L):x x x x
平衡(L):1-x 1-x x x
K=
| x×x |
| (1-x)(1-x) |
解得x=0.5,
达到平衡时生成CO的体积为0.5L,
该反应前后气体总体积不变,所以反应后气体体积仍然为2L,
所以达到平衡时CO的体积分数为:
| 0.5L |
| 2L |
故答案为:20%;
(3)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,
故答案为:N2;氨气氧化生成NO的反应是放热反应,升高温度转化率下降;
(4)容器内的压强与气体的物质的量成正比,容器内的压强为起始时的1.2倍,反应后的气体物质的量为:3mol×1.2mol=3.6mol,增加了0.6mol,
根据反应方程式,利用物质的量差计算:2X(g)?Y(g)+3Z(g) 物质的量变化△n
2 1 3 2
0.3mol 0.9mol 0.6mol
容器容积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与原平衡等效,且起始时维持化学反应向逆反应方向进行,说明生成物Z浓度大于达到平衡时0.9mol;
将3molX气体按照化学计量数全部转化为Z,c有最大值,最大值为4.5mol,所以c的范围为:0.9<c≤4.5,
故答案为:0.9<c≤4.5.
点评:本题考查了化学平衡的计算、等效平衡的判断及应用、化学平衡的影响因素及平衡状态的判断,题目难度较大,试题涉及的知识点较多,充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
化学无处不在,与化学有关的说法正确的是( )
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |
对于溶液中某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
下列过程属于人工固氮的是( )
| A、分离液态空气制氮气 |
| B、闪电时N2 转化为NO |
| C、合成氨 |
| D、豆科作物根瘤菌将N2 转化为NH3 |
下列实验操作或做法正确的是( )
| A、用托盘天平称量5.85 g氯化钠固体 |
| B、从试剂瓶中取Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入原试剂瓶中 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
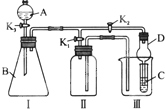 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题: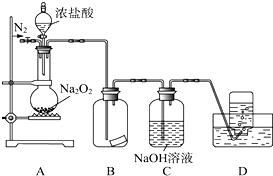 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+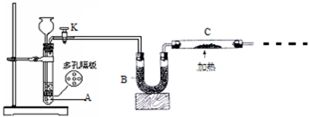 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.