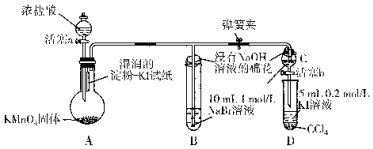
题目内容
17.已知A是碳元素,B是氧元素,C是钠元素,D是铝元素,下列说法正确的是( )| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 四种元素在同一周期 | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
分析 A.同周期元素从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大;
B.元素的非金属性越强,对应的氢化物越稳定;
C.C、O为第二周期,Na、Al为第三周期;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.同周期元素从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,与Si相比较,则原子半径Na>Si,Si>C,则原子半径:Na>C,故A正确;
B.非金属性O>C,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.C、O为第二周期,Na、Al为第三周期,故C错误;
D.金属性Na>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D错误.
故选A.
点评 本题考查了原子结构与元素周期率的关系,为高频考点,侧重考查学生的分析能力,题目难度中等,注意把握元素周期率的递变规律.

练习册系列答案
相关题目
8.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )
| A. | 加少量稀NaOH溶液 | B. | 加入少量NaNO3固体 | ||
| C. | 加入少量NaHSO4固体 | D. | 加入少量CuSO4溶液 |
12.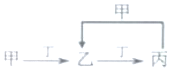 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )| A. | 氢化物的稳定性:Z>Y | B. | 离子半径:Z>Y>X | ||
| C. | W可能是金属元素 | D. | W和X均能与Y形成两种离子化合物 |
2.下列物质间的变化,不能通过与氧气反应一步完成的是( )
| A. | N2→NO2 | B. | Na→Na2O2 | C. | SO2→SO3 | D. | Fe→Fe3O4 |
5.给150mL某液体加热的操作中,所需的仪器是( )
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
| A. | ③⑥⑦⑧ | B. | ②③⑤⑧ | C. | ①③④⑤ | D. | ②③⑤⑥ |
2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
| 选项 | 物质 | 选用的试剂 | 操作方法 |
| ① | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| ② | CO2(CO) | 氧气 | 点燃 |
| ③ | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| ④ | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
3.下列离子方程式与所述事实相符且正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |