题目内容
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )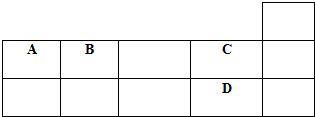

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中位置,可知A为碳、B为氮、C为氟、D为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.HF分子中存在氢键,同主族氢化物中HF的沸点最高,其它氢化物均为分子晶体,结构相似,相对分子质量越大沸点越高;
C.非金属性越强,氢化物越稳定;
D.石墨可以导电.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.HF分子中存在氢键,同主族氢化物中HF的沸点最高,其它氢化物均为分子晶体,结构相似,相对分子质量越大沸点越高;
C.非金属性越强,氢化物越稳定;
D.石墨可以导电.
解答:
解:由元素在周期表中位置,可知A为碳、B为氮、C为氟、D为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Cl>C>N>F,即D>A>B>C,故A错误;
B.HF分子中存在氢键,同主族氢化物中HF的沸点最高,其它氢化物均为分子晶体,结构相似,HCl的相对分子质量最小,分子间作用力最小,故HCl沸点最低,故B正确;
C.同周期自左而右非金属性增强,氢化物稳定性增强,故氢化物的稳定性为A<B<C,故C错误;
D.常温下,石墨可以导电,故D错误,
故选B.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Cl>C>N>F,即D>A>B>C,故A错误;
B.HF分子中存在氢键,同主族氢化物中HF的沸点最高,其它氢化物均为分子晶体,结构相似,HCl的相对分子质量最小,分子间作用力最小,故HCl沸点最低,故B正确;
C.同周期自左而右非金属性增强,氢化物稳定性增强,故氢化物的稳定性为A<B<C,故C错误;
D.常温下,石墨可以导电,故D错误,
故选B.
点评:本题考查元素周期表与元素周期律等,难度不大,注意理解氢键对物质性质的影响,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、24 g氢化钠(NaH)固体中阴离子所含电子总数为2NA |
| B、1 mol/L FeCl3溶液中Fe3+的数目小于NA |
| C、在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA |
| D、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
下列说法正确的是( )
| A、Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]的空间构型为正四面体形 |
| B、NaOH中既有离子键又有共价键和配位键 |
| C、电解饱和食盐水的实验中阳极产生NaOH |
| D、在[Cu(NH3)4]2+离子中,Cu2+提供孤对电子对,NH3提供空轨道 |

