题目内容
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和.
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 .
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为: .
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应: ;负极反应: ;电解质溶液pH的变化 .(填“增大”“减小”或“不变”.下同)
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和.
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是五种常见短周期元素,
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素,即A为氢;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,即C为氧,那么B为氮;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,即D为钠,E为铝;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,经此验证以上推断正确,据此解答各小题即可.
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素,即A为氢;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,即C为氧,那么B为氮;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,即D为钠,E为铝;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,经此验证以上推断正确,据此解答各小题即可.
解答:
解:A、B、C、D、E是五种常见短周期元素,
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素,即A为氢;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,即C为氧,那么B为氮;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,即D为钠,E为铝;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,经此验证以上推断正确,
由分析可知:A为氢,B为氮,C为氧,D为钠,E为铝,
(1)乙为氢氧化钠:NaOH,丙为氢氧化铝:Al(OH)3,两者在溶液中反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)化合物BA3为:NH3,BC为BO,两者在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质即氮气和水,反应的化学方程式为:4NH3+6NO
5N2+6H2O,故答案为:4NH3+6NO
5N2+6H2O;
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素O(原子物质的量之比1:1)形成的化合物:CO,向正极通入元素O最常见的单质:氧气,故CO在负极失去电子发生氧化反应生成二氧化碳气体,氧气在正极得到电子与氢离子结合生成水,故正极反应式为:O2+4e-+4H+=2H2O,负极反应为:2CO-4e-+2H2O=2CO2↑+4H+,总反应式为:O2+2CO=2CO2↑,故溶液的pH不变,故答案为:2CO-4e-+2H2O=2CO2↑+4H+;不变.
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素,即A为氢;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,即C为氧,那么B为氮;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,即D为钠,E为铝;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,经此验证以上推断正确,
由分析可知:A为氢,B为氮,C为氧,D为钠,E为铝,
(1)乙为氢氧化钠:NaOH,丙为氢氧化铝:Al(OH)3,两者在溶液中反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)化合物BA3为:NH3,BC为BO,两者在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质即氮气和水,反应的化学方程式为:4NH3+6NO
| ||
| △ |
| ||
| △ |
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素O(原子物质的量之比1:1)形成的化合物:CO,向正极通入元素O最常见的单质:氧气,故CO在负极失去电子发生氧化反应生成二氧化碳气体,氧气在正极得到电子与氢离子结合生成水,故正极反应式为:O2+4e-+4H+=2H2O,负极反应为:2CO-4e-+2H2O=2CO2↑+4H+,总反应式为:O2+2CO=2CO2↑,故溶液的pH不变,故答案为:2CO-4e-+2H2O=2CO2↑+4H+;不变.
点评:本题主要考查的是元素的推断与燃料电池电极反应方程式的书写,属于常考题.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
假如12C相对原子质量为24,以0.024千克12C所含12C的原子数为阿伏加德罗常数.下列数值肯定不变的是( )
| A、阿伏加德罗常数 |
| B、摩尔质量 |
| C、一定质量气体的体积 |
| D、O2的相对分子质量 |
下列离子方程式书写正确的是( )
| A、过量二氧化碳通人偏铝酸钠溶液中:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- | ||||
| B、氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | ||||
| C、在碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | ||||
D、碳酸氢铵溶液与过量的NaOH溶液混合:NH4++HCO3-+2OH-
|
某学生在一带活塞的密闭容器中装入1molNaHCO3和1molNa2O2,加热充分反应后容器内残留的固体是( )
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )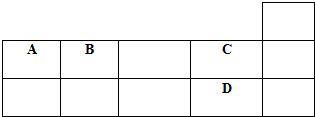

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
下列有关实验操作中,正确的是( )
| A、用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C、向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是( )
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |

 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.