题目内容
为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤.
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液.
步骤II的实验现象如下:
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 .
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 .
I.取少量样品于试管中,加入盐酸,充分反应后过滤.
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液.
步骤II的实验现象如下:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是
考点:性质实验方案的设计
专题:实验设计题
分析:根据滤液甲中滴加氢氧化钠溶液,生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失,则白色沉淀为氢氧化铝;生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色,则白色沉淀为氢氧化亚铁,红褐色沉淀为氢氧化铁;
解答:
解:根据滤液甲中滴加氢氧化钠溶液,生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失,则白色沉淀为氢氧化铝;生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色,则白色沉淀为氢氧化亚铁,红褐色沉淀为氢氧化铁;
(1)则滤液甲中含铝离子,所以甲中金属为铝,生成白色沉淀的反应为:Al3++3OH-═Al(OH)3↓,故答案为:Al; Al3++3OH-═Al(OH)3↓;
(2)根据以上分析,则乙中滤液含有二价铁离子,白色沉淀氢氧化亚铁变成红褐色沉淀氢氧化铁的方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,
故答案为:Fe2+;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(1)则滤液甲中含铝离子,所以甲中金属为铝,生成白色沉淀的反应为:Al3++3OH-═Al(OH)3↓,故答案为:Al; Al3++3OH-═Al(OH)3↓;
(2)根据以上分析,则乙中滤液含有二价铁离子,白色沉淀氢氧化亚铁变成红褐色沉淀氢氧化铁的方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,
故答案为:Fe2+;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
点评:本题主要考查了氢氧化铝和氢氧化亚铁的性质,难度不大,抓住氢氧化铝和氢氧化亚铁的特征来判断是解题的关键;

练习册系列答案
相关题目
下列说法中错误的是( )
| A、1gO2与1gO3所含的原子数目相等 |
| B、不同分散系其对应分散质的微粒直径不同 |
| C、标况下1molCCl4所占体积约为22.4L |
| D、NaCl晶体和熔化的NaCl都属于电解质 |
某学生在一带活塞的密闭容器中装入1molNaHCO3和1molNa2O2,加热充分反应后容器内残留的固体是( )
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )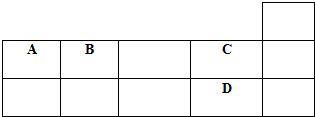

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
下列各组反应,实质都是取代反应的是( )
| A、苯硝化,苯酚和溴水反应,皂化反应,油脂的硬化 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
下列离子方程式中书写正确的是( )
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
 某研究性学习小组探究NO3-在不同环境中的氧化性.
某研究性学习小组探究NO3-在不同环境中的氧化性.