题目内容
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、24 g氢化钠(NaH)固体中阴离子所含电子总数为2NA |
| B、1 mol/L FeCl3溶液中Fe3+的数目小于NA |
| C、在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA |
| D、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
考点:阿伏加德罗常数
专题:
分析:A、根据n=
求出NaH的物质的量,然后根据H-的电子数来分析;
B、溶液体积不明确;
C、合成氨的反应为可逆反应,不能进行彻底;
D、标况下,乙醇为液态.
| m |
| M |
B、溶液体积不明确;
C、合成氨的反应为可逆反应,不能进行彻底;
D、标况下,乙醇为液态.
解答:
解:A、NaH的物质的量n=
=
=1mol,而阴离子为H-,而1molH-含2mol电子,故电子总数为2NA,故A正确;
B、溶液体积不明确,故无法计算Fe3+的个数,故B错误;
C、合成氨的反应为可逆反应,不能进行彻底,故1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数小于NA,故C错误;
D、标况下,乙醇为液态,故D错误.
故选A.
| m |
| M |
| 24g |
| 24g/mol |
B、溶液体积不明确,故无法计算Fe3+的个数,故B错误;
C、合成氨的反应为可逆反应,不能进行彻底,故1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数小于NA,故C错误;
D、标况下,乙醇为液态,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
立方烷(C8H8)的碳架结构如图,则它的五氯代物有( )种


| A、3 | B、4 | C、5 | D、6 |
0.2molNa218O2与足量CO2完全反应后,所得固体质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |
假如12C相对原子质量为24,以0.024千克12C所含12C的原子数为阿伏加德罗常数.下列数值肯定不变的是( )
| A、阿伏加德罗常数 |
| B、摩尔质量 |
| C、一定质量气体的体积 |
| D、O2的相对分子质量 |
将硫酸钾、硫酸铝、硫酸铝钾三种盐溶液混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L,c(Al3+)=0.055mol/L,溶液的 PH=2.0,则 c(K+)为( )
| A、0.045mol/L |
| B、0.035mol/L |
| C、0.055mol/L |
| D、0.040mol/L |
下列说法不正确的是( )
| A、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 |
| B、自发进行的反应一定能迅速进行 |
| C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D、一个反应能否自发进行,可用焓变和熵变共同判断 |
下列说法中错误的是( )
| A、1gO2与1gO3所含的原子数目相等 |
| B、不同分散系其对应分散质的微粒直径不同 |
| C、标况下1molCCl4所占体积约为22.4L |
| D、NaCl晶体和熔化的NaCl都属于电解质 |
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )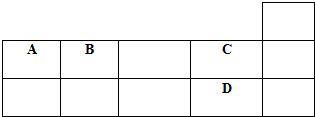

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |