题目内容
下列化学用语或说法错误的是( )
①金属的活泼性决定了金属的冶炼方法,工业上分别用电解熔融的氯化镁、氯化铝的方法冶炼镁和铝
②漂白粉的有效成分是次氯酸钙和氯化钙
③生活中常利用SiO2与NaOH溶液的反应刻蚀玻璃
④向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2.5mol
⑤饱和Na2CO3溶液和Na2SiO3溶液都不能盛放在带磨口玻璃塞的试剂瓶中
⑥FeCl2、Fe(OH)3均可通过化合反应制得
⑦由水电离的c(H+)为10-13mol/L的溶液中,Na+、NO3-、SO42-、I-不一定能大量共存
⑧可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性:2MnO4-+8H++5H2O2=2Mn2++5O2↑+8H2O.
①金属的活泼性决定了金属的冶炼方法,工业上分别用电解熔融的氯化镁、氯化铝的方法冶炼镁和铝
②漂白粉的有效成分是次氯酸钙和氯化钙
③生活中常利用SiO2与NaOH溶液的反应刻蚀玻璃
④向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2.5mol
⑤饱和Na2CO3溶液和Na2SiO3溶液都不能盛放在带磨口玻璃塞的试剂瓶中
⑥FeCl2、Fe(OH)3均可通过化合反应制得
⑦由水电离的c(H+)为10-13mol/L的溶液中,Na+、NO3-、SO42-、I-不一定能大量共存
⑧可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性:2MnO4-+8H++5H2O2=2Mn2++5O2↑+8H2O.
| A、只有④⑤⑦⑧ |
| B、只有①②③⑤ |
| C、只有①②③④⑧ |
| D、只有②③④⑦ |
考点:金属冶炼的一般原理,离子方程式的书写,离子方程式的有关计算,离子共存问题,硅和二氧化硅
专题:
分析:①工业上用电解氧化铝的方法冶炼铝;
②漂白粉的有效成分是次氯酸钙;
③生活中常利用SiO2与HF溶液的反应刻蚀玻璃;
④KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时硫酸根离子全部沉淀;
⑤Na2SiO3溶液具有粘性,碳酸钠水解导致其溶液呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠;
⑥铁和FeCl3反应生成FeCl2,Fe(OH)2被氧气氧化生成Fe(OH)3;
⑦由水电离的c(H+)为10-13mol/L的溶液中,溶液呈强酸性或强碱性,只要离子之间不反应就能共存;
⑧浓盐酸可以被酸性高锰酸钾溶液氧化.
②漂白粉的有效成分是次氯酸钙;
③生活中常利用SiO2与HF溶液的反应刻蚀玻璃;
④KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时硫酸根离子全部沉淀;
⑤Na2SiO3溶液具有粘性,碳酸钠水解导致其溶液呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠;
⑥铁和FeCl3反应生成FeCl2,Fe(OH)2被氧气氧化生成Fe(OH)3;
⑦由水电离的c(H+)为10-13mol/L的溶液中,溶液呈强酸性或强碱性,只要离子之间不反应就能共存;
⑧浓盐酸可以被酸性高锰酸钾溶液氧化.
解答:
解:①Al属于活泼金属,氯化铝为分子晶体,熔融状态下不导电,所以工业上用电解氧化铝的方法冶炼铝,故错误;
②漂白粉的有效成分是次氯酸钙,主要成分是次氯酸钙和氯化钙,故错误;
③生活中常利用SiO2与HF溶液的反应刻蚀玻璃,二者反应生成四氟化硅和水,故错误;
④KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时硫酸根离子全部沉淀;KAl(SO4)2的溶液中加入Ba(OH)2溶液按照1:2反应,铝离子全部反应为偏铝酸钾,沉淀为硫酸钡为2mol,故错误;
⑤Na2SiO3溶液具有粘性,碳酸钠水解导致其溶液呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠,从而将塞子黏住而打不开,所以饱和Na2CO3溶液和Na2SiO3溶液都不能盛放在带磨口玻璃塞的试剂瓶中,故正确;
⑥Fe+2FeCl3=3FeCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以可以通过化合反应实现,故正确;
⑦由水电离的c(H+)为10-13mol/L的溶液中,溶液呈强酸性或强碱性,强酸性条件下,硝酸根离子和碘离子发生氧化还原反应而不能共存,故正确;
⑧浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故错误;
故选C.
②漂白粉的有效成分是次氯酸钙,主要成分是次氯酸钙和氯化钙,故错误;
③生活中常利用SiO2与HF溶液的反应刻蚀玻璃,二者反应生成四氟化硅和水,故错误;
④KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时硫酸根离子全部沉淀;KAl(SO4)2的溶液中加入Ba(OH)2溶液按照1:2反应,铝离子全部反应为偏铝酸钾,沉淀为硫酸钡为2mol,故错误;
⑤Na2SiO3溶液具有粘性,碳酸钠水解导致其溶液呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠,从而将塞子黏住而打不开,所以饱和Na2CO3溶液和Na2SiO3溶液都不能盛放在带磨口玻璃塞的试剂瓶中,故正确;
⑥Fe+2FeCl3=3FeCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以可以通过化合反应实现,故正确;
⑦由水电离的c(H+)为10-13mol/L的溶液中,溶液呈强酸性或强碱性,强酸性条件下,硝酸根离子和碘离子发生氧化还原反应而不能共存,故正确;
⑧浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故错误;
故选C.
点评:本题考查较综合,涉及物质的量的计算、离子共存、氧化还原反应、金属的冶炼等知识点,侧重考查学生综合知识运用能力,注意铝的冶炼方法,会根据离子方程式进行有关计算,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列说法不正确的是( )
| A、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 |
| B、自发进行的反应一定能迅速进行 |
| C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D、一个反应能否自发进行,可用焓变和熵变共同判断 |
某学生在一带活塞的密闭容器中装入1molNaHCO3和1molNa2O2,加热充分反应后容器内残留的固体是( )
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )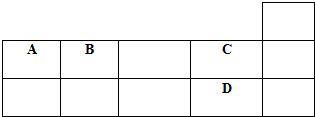

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
下列有关实验操作中,正确的是( )
| A、用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C、向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
下列各组反应,实质都是取代反应的是( )
| A、苯硝化,苯酚和溴水反应,皂化反应,油脂的硬化 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是( )
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |
 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答: