题目内容
(1)某研究性合作学习组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图:

①装置E中的药品为 ;已知3Cl2+8NH3═6NH4Cl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体慢慢消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为 .
②请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式: ,请写出试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是 .
(2)氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题:
①a电极的电极反应式为 ;
②反应一段时间后,电解质溶液的pH将 (填“增大”“减小”或“不变”);
③已知:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
试写出氨气完全燃烧生成气态水的热化学方程式: .

①装置E中的药品为
②请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式:
(2)氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题:

①a电极的电极反应式为
②反应一段时间后,电解质溶液的pH将
③已知:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
试写出氨气完全燃烧生成气态水的热化学方程式:
考点:氨的制取和性质,用盖斯定律进行有关反应热的计算,化学电源新型电池,氯气的实验室制法
专题:电化学专题,卤族元素,氮族元素
分析:(1)①氯气和氨气反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵,氯气的颜色消失;发生一系列的反应后烧杯内的气体压强变小,形成喷泉;
②KMnO4和浓盐酸反应制取氯气;氯气有强氧化性,能氧化还原性的微粒,根据溶液中颜色的变化判断微粒氧化性的强弱;
(2)①燃料电池中,负极上是燃料氨发生失电子的氧化反应;
②根据电极反应式结合氢离子和氢氧根离子浓度的变化来确定溶液pH的变化;
③根据盖斯定律结合热化学方程式的书写方法来书写即可.
②KMnO4和浓盐酸反应制取氯气;氯气有强氧化性,能氧化还原性的微粒,根据溶液中颜色的变化判断微粒氧化性的强弱;
(2)①燃料电池中,负极上是燃料氨发生失电子的氧化反应;
②根据电极反应式结合氢离子和氢氧根离子浓度的变化来确定溶液pH的变化;
③根据盖斯定律结合热化学方程式的书写方法来书写即可.
解答:
解:(1)①常用碱石灰干燥氨气;氯气和氨气反应生成氯化氢和氮气,氯化氢和氨气相遇立即反应生成白烟氯化铵,所以看到的现象是黄绿色气体消失,产生白烟;反应一段时间后,关闭b打开c,烧瓶内气体压强小于空气压强导致烧杯中的液体进入烧瓶中,形成喷泉;
故答案为:碱石灰;烧杯中的液体进入烧瓶中,形成喷泉;
②KMnO4和浓盐酸反应制取氯气,不需要加热,反应离子方程式为2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:KMnO4和浓盐酸反应制取氯气;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
(2)①该燃料电池中,负极上燃料氨气失电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-═N2+6H2O,故答案为:2NH3-6e-+6OH-═N2+6H2O;
②反应一段时间后,由于电池反应生成水,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,故答案为:减小;
③已知:a:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
b:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
根据盖斯定律,反应4NH3(g)+3O2(g)═2N2(g)+6H2O(g)可以由b×3-a×2得到,所以该反应焓变△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266 kJ/mol.
故答案为:碱石灰;烧杯中的液体进入烧瓶中,形成喷泉;
②KMnO4和浓盐酸反应制取氯气,不需要加热,反应离子方程式为2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:KMnO4和浓盐酸反应制取氯气;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
(2)①该燃料电池中,负极上燃料氨气失电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-═N2+6H2O,故答案为:2NH3-6e-+6OH-═N2+6H2O;
②反应一段时间后,由于电池反应生成水,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,故答案为:减小;
③已知:a:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
b:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
根据盖斯定律,反应4NH3(g)+3O2(g)═2N2(g)+6H2O(g)可以由b×3-a×2得到,所以该反应焓变△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266 kJ/mol.
点评:本题考查了氧化性和还原性的比较、电化学等知识点,难度不大,注意碱性条件下电极反应式的书写.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )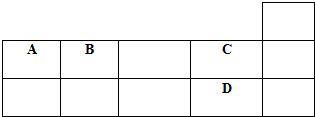

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
已知在标准状况下的四种气体 ①6.72L CH4;②3.01×1023个HCl分子;③13.6克H2S;④0.2molNH3该条件下体积最大和含氢原子数最多的依次是( )
| A、②和① | B、②和④ |
| C、①和④ | D、③和① |
下列离子方程式中书写正确的是( )
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
0.1mol有机物A恰好与标准状况下4.48LHCl发生加成反应,得到产物B,该产物最多与0.4mol Cl2在光照条件下发生取代反应,则有机物A可能为( )
| A、C2H2 |
| B、C2H4 |
| C、C2H6 |
| D、C3H6 |
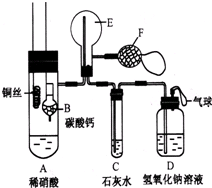 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答: