题目内容
4.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+3m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$(A-Z+2m)mol |
分析 根据中子数=质量数-质子数,计算X原子中子数,进而计算每个HmX分子含有中子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有中子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个质子,则中子数为(A-Z),则每个HmX分子含有中子数为(A-Z+2m),ag HmX的物质的量为$\frac{ag}{(A+3m)g/mol}$=$\frac{a}{A+3m}$mol,故含有中子物质的量为$\frac{a}{A+3m}$(A-Z+2m)mol;
故选D.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.设NA表示阿伏加德罗常数的数值,下列叙述不正确的是( )
| A. | 1.5 g甲基所含有的电子数目为0.9NA | |
| B. | 在1L0.1 mol•L-1Na2S溶液中,阴离子总数大于0.1NA | |
| C. | 78g Na2O2与足量CO2完全反应,转移的电子总数为NA | |
| D. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3 molI2,则转移6NA个电子 |
8.某稀溶液中含有4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( )
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |
12.将铝片和铜片用导线连接后,插人盛浓硝酸的烧杯中,下列叙述正确的是( )
| A. | Al比Cu活泼,Al为负极,Cu极上析出NO2 | |
| B. | Cu比Al活泼,Cu为负极,Al极上析出Cu | |
| C. | Cu为负极,电极反应:Cu-2e-═Cu2+ | |
| D. | Al为正极,电极反应:2H++2e-═H2↑ |
14.海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是( )
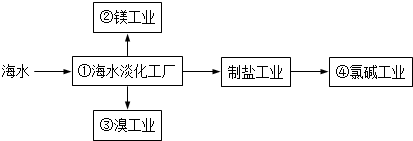

| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
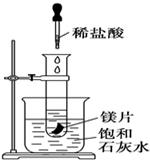 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: