题目内容
14.海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是( )
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
分析 A.海水淡化可利用太阳能光照,采取蒸馏原理获得;
B.海水中得到镁,需要首先从海水中获得氯化镁,然后再去电解熔融状态的氯化镁即得镁;
C.根据从海水中提取溴的过程解答,海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质,不涉及复分解反应;
D.海水中含有氯化钠,经过海水蒸发制得氯化钠,根据电解熔融氯化钠或电解氯化钠溶液的原理分析.
解答 解:A.利用蒸馏原理可从海水中提取淡水,故A正确;
B.从海水中得到氯化镁后,镁为活泼金属,则可以电解熔融状态的氯化镁生成氯气和金属镁,故B正确;
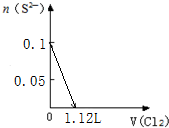
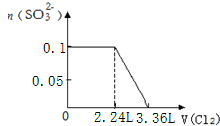
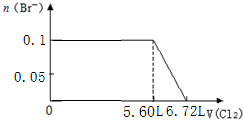
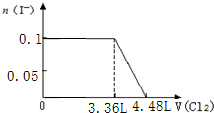
C.将苦卤浓缩通入过量氯气进行氧化,静置溴沉在底部,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集溴,然后再用氯气将其氧化得到溴,反应过程中不涉及复分解反应,故C错误;
D.从海水中得到氯化钠后,电解氯化钠溶液,得氢氧化钠和氢气和氯气,利用制得的氯气可以生产盐酸和漂白液,故D正确;
故选C.
点评 本题以海水资源的开发利用,考查海水的淡化、镁的冶炼、氯碱工业及溴的提取得到,利用所学知识结合框图信息是解答本题的关键,难度不大.

练习册系列答案
相关题目
4.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+3m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$(A-Z+2m)mol |
2.Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.4g,下列分析正确的是( )
| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | C. | 可能含有NaHCO3 | D. | 一定含有NaCl |
4.一种新型钠硫电池结构示意图如图,下列有关该电池的说法正确的是( )


| A. | B极中填充多孔的炭或石墨毡,目的是为了增加导电性 | |
| B. | 电池放电时,A极电极反应为:2Na++xS+2 e-=Na2SX | |
| C. | 电池放电时,Na+向电极A极移动 | |
| D. | 电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子 |
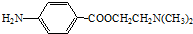 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):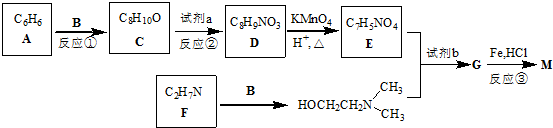
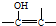 的结构不稳定.
的结构不稳定.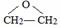 FH3C-NH-CH3
FH3C-NH-CH3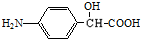 .
. .
.