题目内容
17.中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:(1)中学化学实验中的中和热的测定需要在大小烧杯之间填满碎泡沫(或纸条)其作用是保温、隔热、减少实验过程中的热量散失.
(2)该实验常用0.50mol•L-1 HCl和0.55mol•L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是使盐酸完全被中和,减少了盐酸挥发对实验的影响.当室温低于10℃时进行,对实验结果会造成较大的误差其原因是如果温度过低,散热加快,对实验结过造成的误差较大.
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),则该中和反应放出热量为0.418(t2-t1)kJ(填表达式).△H=-$\frac{0.418(t2-t1)}{0.025}$kJ/mol(填表达式)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等、不相等”) 所放出的热量不相等(填“相等、不相等”)
(5)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
分析 (1)中和热测定实验成败的关键是保温工作;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
解答 解:(1)大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
故答案为:保温、隔热、减少实验过程中的热量散失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和;当室温低于10℃时进行,散热加快,对实验结过造成的误差较大;
故答案为:使盐酸完全被中和,减少了盐酸挥发对实验的影响;如果温度过低,散热加快,对实验结过造成的误差较大;
(3)0.50mol•L-1HCl和0.55mol•L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为:0.05L×0.50mol•L-1=0.025mol,溶液的质量为:100ml×1g/ml=100g,设反应前后的温度值分别用t1和t2表示,温度变化的值△T=t2-t1,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×(t2-t1)=0.418(t2-t1)kJ;所以实验测得的中和热为:△H=-$\frac{0.418(t2-t1)}{0.025}$kJ/mol;
故答案为:0.418(t2-t1);-$\frac{0.418(t2-t1)}{0.025}$kJ/mol;
(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等;
故答案为:相等;不相等;
(5)醋酸为弱酸,电离过程为吸热过程,所以用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液,反应放出的热量偏小,故答案为:偏小.
点评 本题主要考查学生有关中和热的测定知识,可以根据所学知识进行回答,注意对中和热概念的理解,难度不大.

 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | 1.0摩尔 | B. | 1.6摩尔 | C. | 2.2摩尔 | D. | 2.0摩尔 |
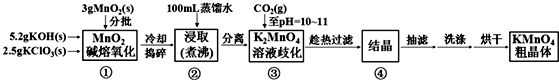
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
实验流程如下:
请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
| A. | Na+和He | B. | H2O和D2O | C. | NH4+和NH3 | D. | H2SO4和H3PO4 |