题目内容
6.下列叙述正确的是( )| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
分析 A、化学反应在发生物质变化的同时还伴随着能量的变化;
B、燃烧是指发光、放热剧烈的氧化还原反应,物质燃烧一定是放热反应;
C、有的放热的化学反应需要加热才能发生;
D、有的吸热反应不加热也会发生.
解答 解:A、化学反应在发生物质变化的同时还一定伴随着能量的变化,故A正确;
B、物质燃烧一定是放热反应,故B错误;
C、有的放热的化学反应需要加热才能发生,如铝热反应,故C错误;
D、有的吸热反应不加热也会发生,如氯化铵和氢氧化钡晶体的反应,故D错误.
故选A.
点评 本题考查学生常见的吸热反应和放热反应,以及化学反应中能量变化的原因,可以根据教材知识来回答,题目较简单.

练习册系列答案
相关题目
14.下列有机物的命名中,正确的是( )
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 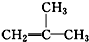 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素同周期,X的金属性再同周期元素中最强,Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位,W的最高价氧化物的水化物的化学式为HnWO2n+2,下列说法正确的是( )
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | X、W分别形成的氢化物中所含化学键种类相同 | |
| D. | Z、W形成化合物的电子式为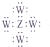 |
11.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:⑥Si⑪Ca.
(2)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是K、F(用元素符号作答).
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式:Al(OH)3+3HCl=AlCl3+3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该方程式NH3+HNO3=NH4NO3或 H2S+3H2SO4(浓)=4SO2+4H2O.
(5)在⑤与④中,设计简单的实验(只要写出实验方案即可),证明其金属性的强弱,方案分别取大小和形状相同的Mg和Al与浓度相同的盐酸反应,观察产生气泡的速率,比较快的是Mg,故Mg金属性强;
(6)如何元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是K、F(用元素符号作答).
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式:Al(OH)3+3HCl=AlCl3+3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该方程式NH3+HNO3=NH4NO3或 H2S+3H2SO4(浓)=4SO2+4H2O.
(5)在⑤与④中,设计简单的实验(只要写出实验方案即可),证明其金属性的强弱,方案分别取大小和形状相同的Mg和Al与浓度相同的盐酸反应,观察产生气泡的速率,比较快的是Mg,故Mg金属性强;
(6)如何元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
18.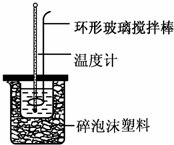 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.大烧杯如不盖硬纸板,求得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在保温杯中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容C按4.18J•(g•℃)-1计算,结果保留小数点后一位).
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF(填字母序号).
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.大烧杯如不盖硬纸板,求得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在保温杯中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容C按4.18J•(g•℃)-1计算,结果保留小数点后一位).
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF(填字母序号).
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
16.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
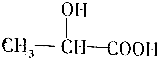 ,
,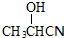 .
.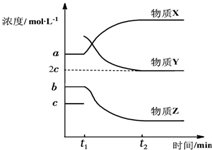 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: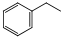 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$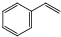 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1