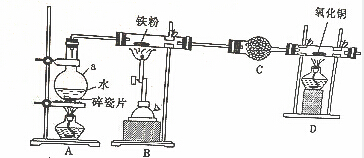
题目内容
9.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
实验流程如下:
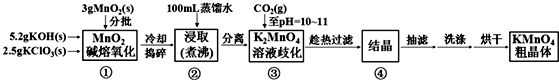
请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
分析 根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体.
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应;
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应;
②当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾;
③如果溶液中存在K2MnO4,通入CO2会产生沉淀;K2MnO4溶液显绿色,KMnO4溶液紫红色;
(3)加热时高锰酸钾会分解生成锰酸钾;
(4)①容量瓶规格要等于或稍大于配制溶液体积,所以配制90mL该溶液时需要100mL容量瓶,根据m=cVM计算草酸晶体质量;
②酸性溶液只能用酸式滴定管量取,碱性溶液只能用碱式滴定管量取;
若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小.
解答 解:根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体,
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,步骤①中含有KOH碱性物质,KOH能和SiO2反应生成硅酸钾,所以应该用铁坩埚熔融,故选:D;
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,所以不能选取,硫酸酸性太强,可以选取醋酸,故选:B;
②当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低,
故答案为:二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低;
③紫色颜色较深,可以掩盖绿色,只通过颜色变化不能说明歧化反应完全,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,说明发生歧化反应,不能说明歧化反应完全,控制反应条件pH为10~11,不能说明歧化反应完全,如果溶液中存在K2MnO4,通入CO2会产生沉淀,且K2MnO4溶液显绿色,KMnO4溶液紫红色,所以可以通过通入二氧化碳是否产生沉淀,故选:B;
(3)如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低,
故答案为:如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解;
(4)①容量瓶规格要等于或稍大于配制溶液体积,所以配制90mL该溶液时需要100mL容量瓶,草酸晶体质量m=cVM=1.5mol/L×0.1L×126g/mol=18.9g,故答案为:18.9;
②酸性溶液只能用酸式滴定管量取,碱性溶液只能用碱式滴定管量取,高锰酸钾溶液具有酸性,应该用酸式滴定管量取;
若该滴定管用蒸馏水洗净后未润洗,会稀释溶液浓度,则最终测定结果将偏小,
故答案为:酸式;偏小.
点评 本题考查制备实验方案设计,涉及仪器的选取、物质检验、对操作的分析评价、物质的量的计算、氧化还原反应滴定等知识点,侧重考查学生分析计算、获取信息与迁移运用能力,是对学生综合能力的考查.

| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 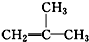 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | X、W分别形成的氢化物中所含化学键种类相同 | |
| D. | Z、W形成化合物的电子式为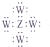 |
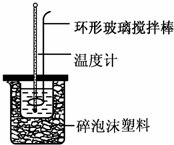 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.大烧杯如不盖硬纸板,求得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在保温杯中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容C按4.18J•(g•℃)-1计算,结果保留小数点后一位).
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF(填字母序号).
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |

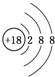 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.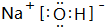
 HClO+HCl.
HClO+HCl.