题目内容
4.氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术.有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气.光伏发电是当今世界利用太阳能最主要方式之一.图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列说法不正确的是( )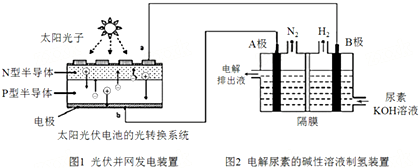
| A. | 图1中N型半导体为负极 | |
| B. | 若A极产生7.00gN2,则此时B极产生16.8L H2(标况下) | |
| C. | 电解完毕后电解液的pH增大 | |
| D. | 该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
分析 该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,结合电解池的工作原理分析解答.
解答 解:A.该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极,故A正确;
B.根据电子守恒有N2~3H2,则n(H2)=3n(N2)=$3×\frac{7.00g}{28g/mol}$=0.75mol,标况下体积为V(H2)=0.75mol×22.4L/mol=16.8L,故B正确;
C.由两极反应得电池总反应为CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$CO32-+N2↑+3H2↑,氢氧根参加反应,导致溶液中氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.A极为阳极,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,故D正确;
故选C.
点评 本题考查了电解原理,明确元素化合价变化与阴阳极的关系是解本题关键,根据电解池的工作原理来分析解答,难度中等.

练习册系列答案
相关题目
9.晚唐诗人李商隐的《无题•相见时难别亦难》中写到“春蚕到死丝方尽,蜡炬成灰泪始干”,下列说法正确的是( )
| A. | 蚕丝属于纤维素 | |
| B. | 蜡烛的主要成分是石蜡,属于混合物 | |
| C. | “泪”是指石蜡燃烧生成的水 | |
| D. | 蚕丝和石蜡完全燃烧所得产物相同 |
10.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
7.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O═2Zn(OH)42-.下列说法正确的是( )
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
16.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
2.下列实验所采取的方法正确的是( )
| A. | 除去甲酸乙酯中甲酸和乙醇,加入饱和纯碱溶液,振荡静置后分液 | |
| B. | 除去蛋白质溶液中氨基酸,加Na0H溶液后分液 | |
| C. | 分离高级脂肪酸钠和甘油,加水后分液 | |
| D. | 除去甲苯中的苯酚,加入过量浓溴水后过滤 |
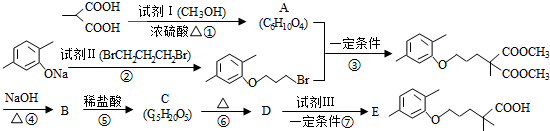
 (R1和R2代表烷基)
(R1和R2代表烷基)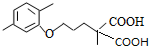 $\stackrel{加热}{→}$
$\stackrel{加热}{→}$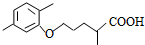 +CO2↑.
+CO2↑.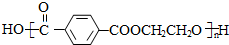 .
.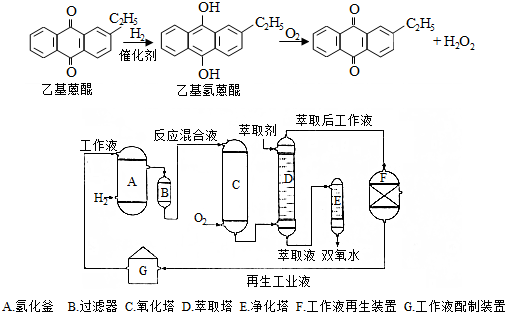
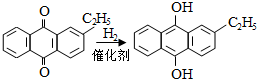 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.