题目内容
10.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
分析 Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,正极反应为:2AgCl+2e-═2C1-+2Ag,负极反应式为:Mg-2e-=Mg2+,据此分析.
解答 解:A.活泼金属镁作负极,失电子发生氧化反应,反应式为:Mg-2e-=Mg2+,故A正确;
B.AgCl是难溶物,其电极反应式为:2AgCl+2e-═2C1-+2Ag,故B错误;
C.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故C正确;
D.镁是活泼金属与水反应,即Mg+2H2O=Mg(OH)2+H2↑,故D正确;
故选:B.
点评 本题考查原电池工作原理,注意常见物质的性质,如镁的还原性以及银离子的氧化性是解题的关键,题目难度中等.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温常压下,2.0g重水(D2O)中含NA个电子 | |
| C. | 1.0L0.1mo1•L-1的NaHCO3溶液中含HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g |
5.今有FeS和FeBr2混合物,其中Fe元素的质量分数为56%,则溴元素的质量分数为( )
| A. | 20% | B. | 15% | C. | 12% | D. | 10% |
15.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1mol N2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 1mol Fe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的共价键数为0.4NA |
2.在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:
下列说法不正确的是( )
| 对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
| 沸点/℃ | 138 | 144 | 139 | 80 |
| 熔点/℃ | 13 | -25 | -47 | 6 |
| A. | 该反应属于取代反应 | |
| B. | 甲苯的沸点高于144℃ | |
| C. | 用蒸馏的方法可将苯从反应所得产物中首先分离出来 | |
| D. | 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 |
4.氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术.有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气.光伏发电是当今世界利用太阳能最主要方式之一.图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列说法不正确的是( )
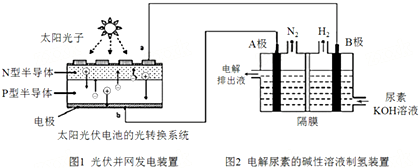

| A. | 图1中N型半导体为负极 | |
| B. | 若A极产生7.00gN2,则此时B极产生16.8L H2(标况下) | |
| C. | 电解完毕后电解液的pH增大 | |
| D. | 该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
5.下列物质中属于混合物的是( )
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
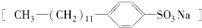 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
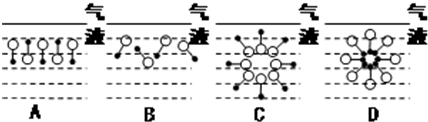
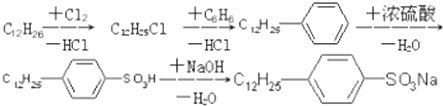
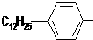 .
.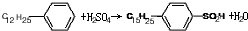 ,反应类型为取代反应.
,反应类型为取代反应.