题目内容
16.下列有关物质性质的比较顺序中,不正确的是( )| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
分析 A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
B.同类型的分子,相对分子质量越大,沸点越大;
C.金属性越强,对应最高价氧化物的水化物碱性越强;
D.金属晶体的电荷越高,半径越小,熔点越大.
解答 解:A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,离子半径为S2->Cl->Na+>Al3+,故A错误;
B.同类型的分子,相对分子质量越大,沸点越大,则沸点为F2<Cl2<Br2<I2,故B正确;
C.金属性越强,对应最高价氧化物的水化物碱性越强,则碱性为LiOH<NaOH<KOH<RbOH,故C正确;
D.金属晶体的电荷越高,半径越小,熔点越大,则熔点为Li>Na>K>Rb,故D正确;
故选A.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
2.在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:
下列说法不正确的是( )
| 对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
| 沸点/℃ | 138 | 144 | 139 | 80 |
| 熔点/℃ | 13 | -25 | -47 | 6 |
| A. | 该反应属于取代反应 | |
| B. | 甲苯的沸点高于144℃ | |
| C. | 用蒸馏的方法可将苯从反应所得产物中首先分离出来 | |
| D. | 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 |
4.氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术.有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气.光伏发电是当今世界利用太阳能最主要方式之一.图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列说法不正确的是( )
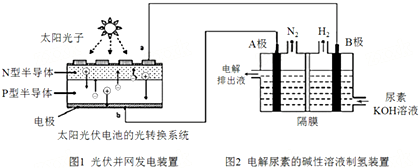

| A. | 图1中N型半导体为负极 | |
| B. | 若A极产生7.00gN2,则此时B极产生16.8L H2(标况下) | |
| C. | 电解完毕后电解液的pH增大 | |
| D. | 该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
11.下列实验操作能达到实验目的是( )
| A. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
1.下列有关实验的操作正确的是( )
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移除导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
8.某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1-xCoO2+LixC6═LiCoO2+C6(x<1),下列关于该电池的说法不正确的是( )
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-═xLi++C6 | |
| C. | 充电时,若转移1mol e-,石墨(C6)电极将增重7x g | |
| D. | 充电时,阳极的电极反应式为LiCoO2-xe-═Li1-xCoO2+xLi+ |
5.下列物质中属于混合物的是( )
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
①盐酸 ②液氯 ③漂白粉 ④碘酒 ⑤氯水.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
14.下列分析中正确是( )
| A. | 含有碳元素的化合物不一定是烃 | |
| B. | 正丁烷分子中四个碳原子可能在同一直线上 | |
| C. | 常温常压下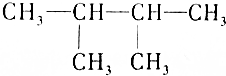 呈气态 呈气态 | |
| D. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 |
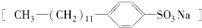 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
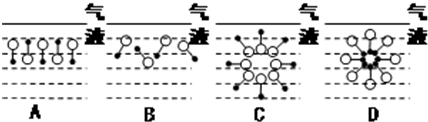
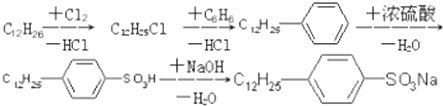
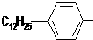 .
.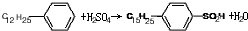 ,反应类型为取代反应.
,反应类型为取代反应.