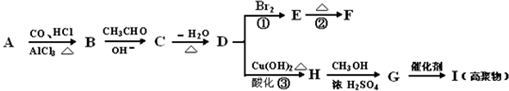
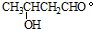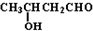题目内容
2012年4月15日,中央电视台曝光某些企业用工业明胶制成药用胶囊,流入市场,危害消费者的身体健康.工业明胶生产过程中使用含铬物质做催化剂.铬及其化合物在生产生活中具有十分广泛的用途.
I.交警使用的一种酒精测试仪就利用了K2Cr2O7的强氧化性.反应的原理是2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,该反应中若有46g乙醇参加反应,转移电子的数目是 .
Ⅱ.含铬废水必须经过处理与净化才能排放.
化工厂对产生的含Cr2O72-的废水通常有如下两种处理工艺:
[工艺一]利用电解原理:向废水中加入适量的NaCl(增强溶液的导电性),用Fe做电极进行电解,Cr2O72-被还原为Cr3+,然后转化为Cr(OH)3沉淀除去.
[工艺二]利用原电池原理:在处理池中,焦炭和铁屑与酸性Cr2O72-溶液形成原电池,使Cr2O72-转化为Cr3+,再在碱性溶液中把Cr3+沉淀析出.其工艺流程如图:

(1)[工艺一]中,将Cr2O72-转化成Cr3+的还原剂是 .
(2)[工艺二]中,处理池中原电池反应的总反应式为:Cr2O72-+3Fe+14H+=2Cr3++3Fe2++7H2O,该电池的正极反应式为: .
(3)沉淀池中,可用石灰乳对Cr3+进行沉降.写出沉降Cr3+的离子方程式: .
Ⅲ.重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠是重要的化工产品.在工业上用铬铁矿[主要成分是Fe(CrO2)2,其中铬元素为+3价]为原料生产.
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成 .
(2)工业生产过程中将铬铁矿与某物质X混合,高温煅烧,矿石中难溶于水的Fe(CrO2)2生成可溶于水的Na2CrO4,反应的化学方程式为4Fe(CrO2)2+8X+7O2=2Fe2O3+8Na2CrO4+8CO2,则X的化学式是 .为了加快该反应的反应速率,可采取的措施有 .(回答两条即可)
I.交警使用的一种酒精测试仪就利用了K2Cr2O7的强氧化性.反应的原理是2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,该反应中若有46g乙醇参加反应,转移电子的数目是
Ⅱ.含铬废水必须经过处理与净化才能排放.
化工厂对产生的含Cr2O72-的废水通常有如下两种处理工艺:
[工艺一]利用电解原理:向废水中加入适量的NaCl(增强溶液的导电性),用Fe做电极进行电解,Cr2O72-被还原为Cr3+,然后转化为Cr(OH)3沉淀除去.
[工艺二]利用原电池原理:在处理池中,焦炭和铁屑与酸性Cr2O72-溶液形成原电池,使Cr2O72-转化为Cr3+,再在碱性溶液中把Cr3+沉淀析出.其工艺流程如图:

(1)[工艺一]中,将Cr2O72-转化成Cr3+的还原剂是
(2)[工艺二]中,处理池中原电池反应的总反应式为:Cr2O72-+3Fe+14H+=2Cr3++3Fe2++7H2O,该电池的正极反应式为:
(3)沉淀池中,可用石灰乳对Cr3+进行沉降.写出沉降Cr3+的离子方程式:
Ⅲ.重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠是重要的化工产品.在工业上用铬铁矿[主要成分是Fe(CrO2)2,其中铬元素为+3价]为原料生产.
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成
(2)工业生产过程中将铬铁矿与某物质X混合,高温煅烧,矿石中难溶于水的Fe(CrO2)2生成可溶于水的Na2CrO4,反应的化学方程式为4Fe(CrO2)2+8X+7O2=2Fe2O3+8Na2CrO4+8CO2,则X的化学式是
考点:氧化还原反应的电子转移数目计算,氧化还原反应,化学平衡的影响因素,难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用
专题:
分析:I.该反应中Cr元素化合价由+6价变为+3价、C元素化合价由-2价变为0价,根据乙醇和转移电子之间关系式计算;
II.(1)阳极上铁失电子生成亚铁离子,亚铁离子具有还原性,将Cr2O72-还原为Cr3+;
(2)在原电池的正极上发生得电子的还原反应,据此书写电极反应;
(3)根据复分解反应的特点来回答;
Ⅲ.(1)类比Na2SiO3可写成Na2O?SiO2完成Fe(CrO2)2的氧化物的形式;
(2)根据元素守恒以及影响化学反应速率的因素分析.
II.(1)阳极上铁失电子生成亚铁离子,亚铁离子具有还原性,将Cr2O72-还原为Cr3+;
(2)在原电池的正极上发生得电子的还原反应,据此书写电极反应;
(3)根据复分解反应的特点来回答;
Ⅲ.(1)类比Na2SiO3可写成Na2O?SiO2完成Fe(CrO2)2的氧化物的形式;
(2)根据元素守恒以及影响化学反应速率的因素分析.
解答:
解:I.该反应中Cr元素化合价由+6价变为+3价、C元素化合价由-2价变为0价,乙醇的物质的量=
=1mol,1mol乙醇完全反应转移电子数目=1mol×2×2×NA/mol=4NA,故答案为:4NA;
II.(1)阳极上铁失电子生成Fe 2+,Fe 2+ 具有还原性,将Cr2O72-还原为Cr3+,故答案为:Fe 2+;
(2)在原电池的正极上发生得电子的还原反应,即Cr2O72-+6e-+14H+=2Cr3++7H2O,故答案为:Cr2O72-+6e-+14H+=2Cr3++7H2O;
(3)沉淀池中,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:Cr3++Ca(OH)2=Ca2++Cr(OH)3↓,故答案为:Cr3++Ca(OH)2=Ca2++Cr(OH)3↓;
Ⅲ.(1)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(2)反应的化学方程式为4Fe(CrO2)2+8X+7O2=2Fe2O3+8Na2CrO4+8CO2,根据元素守恒在,则X的化学式是Na2CO3,增大反应物的接触面积可以加快反应速率,升高温度可以加快反应速率,
故答案为:Na2CO3;粉碎矿石、升高温度等.
| 46 |
| 46g/mol |
II.(1)阳极上铁失电子生成Fe 2+,Fe 2+ 具有还原性,将Cr2O72-还原为Cr3+,故答案为:Fe 2+;
(2)在原电池的正极上发生得电子的还原反应,即Cr2O72-+6e-+14H+=2Cr3++7H2O,故答案为:Cr2O72-+6e-+14H+=2Cr3++7H2O;
(3)沉淀池中,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:Cr3++Ca(OH)2=Ca2++Cr(OH)3↓,故答案为:Cr3++Ca(OH)2=Ca2++Cr(OH)3↓;
Ⅲ.(1)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(2)反应的化学方程式为4Fe(CrO2)2+8X+7O2=2Fe2O3+8Na2CrO4+8CO2,根据元素守恒在,则X的化学式是Na2CO3,增大反应物的接触面积可以加快反应速率,升高温度可以加快反应速率,
故答案为:Na2CO3;粉碎矿石、升高温度等.
点评:本题考查重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用,难度较大.侧重考查学生的分析、理解等综合能力.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应.下列说法正确的是( )
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
反应过程中固体物质质量增加的是 ( )
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
下列各组物质的性质比较中不正确的是( )
| A、热稳定性:H2S>PH3>SiH4 |
| B、原子半径:Na>Mg |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、结合质子能力:Cl->S2- |
下列反应的离子方程式书写正确的是( )
| A、硫酸铜溶液中加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
| B、用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+═NO↑+I2+H2O |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
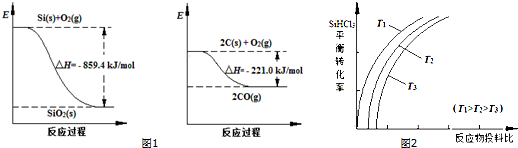

 .2CH3CHO
.2CH3CHO