题目内容
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.(1)如是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1
则反应CO(g)+
| 1 |
| 2 |
(3)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,平衡时H2的转化率为
(4)在固定体积的密闭容器中,1.0×103kPa时反应 N2(g)+3H2(g)?2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
②下列各项能说明上述合成氨反应一定达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变.
考点:热化学方程式,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)反应为放热反应,反应热等于反应物活化能减生成物活化能;
(2)利用盖斯定力计算反应热;
(3)根据反应的化学方程式,利用三段式法计算;
(4)反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小;达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
(2)利用盖斯定力计算反应热;
(3)根据反应的化学方程式,利用三段式法计算;
(4)反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小;达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
解答:
解:(1)NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=(134kJ/mol)-(368kJ/mol)=-234 kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ?mol-1;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1,
利用盖斯定律将①×
+②×
可得CO(g)+
O2(g)=CO2(g)△H=
×(+180kJ?mol-1+(-746kJ?mol-1))=-283J?mol-1,
故答案为:-283;
(3)N2(g)+3H2(g)?2NH3(g)
起始(moL/L) 0.1 0.3 0
转化(moL/L)0.05 0.15 0.1
平衡(moL/L)0.05 0.15 0.1
平衡时H2的转化率为
×100%=50%,
该反应的平衡常数K=
;
故答案为;50;
;
(4)①反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小,则K1>K2,故答案为:>;
②a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.NH3的浓度保持不变,可说明达到平衡状态,故b正确;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.因体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:bc.
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ?mol-1;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1,
利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-283;
(3)N2(g)+3H2(g)?2NH3(g)
起始(moL/L) 0.1 0.3 0
转化(moL/L)0.05 0.15 0.1
平衡(moL/L)0.05 0.15 0.1
平衡时H2的转化率为
| 0.15 |
| 0.3 |
该反应的平衡常数K=
| c2(NH3) |
| c(N2)c3(H2) |
故答案为;50;
| c2(NH3) |
| c(N2)c3(H2) |
(4)①反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小,则K1>K2,故答案为:>;
②a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.NH3的浓度保持不变,可说明达到平衡状态,故b正确;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.因体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:bc.
点评:本题考查较为综合,涉及化学反应与能量、化学平衡的影响因素、化学平衡的计算等,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意利用三段式法计算,较为直观,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )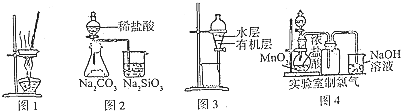

| A、用图l所示装置蒸干AlC13饱和溶液制备AlCl3晶体 |
| B、用图2所示装置证明非金属性Cl>C>Si |
| C、用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D、用图4所示装置制取少量Cl2气体 |
将c(H+)=1×10-2mol?L-1的CH3COOH和HNO3溶液分别加水稀释100倍,稀释后两溶液的c(H+)分别为a和b.则a和b的关系为( )
| A、a>b | B、a=b |
| C、a<b | D、不能确定 |
汽车尾气中的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
| A、氮氧化物 | B、氮气 |
| C、水蒸气 | D、氧气 |

