题目内容
7. (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
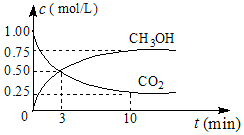
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
分析 (1)①从充分利用太阳能的角度分析;
②根据v=$\frac{△c}{△t}$计算反应速率;
③化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变;
(2)①A、依据平衡常数随温度变化和平衡移动原理分析判断;
B、△H-T△S<0的反应能够自发进行;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、正反应吸热,温度越低反应物转化率越高;
②A.充入CO,使体系总压强增大,但一氧化碳本身转化率降低;
B.将CH3OH(g)从体系中分离,平衡正向移动;
C.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动;
D.使用高效催化剂,反应速率加快,但平衡不移动;
解答 解:(1)①电解水、高温以及天然气的使用都会消耗能源,不符合低碳要求,使用太阳能可减小低碳,故答案为:C;
②v(CO2)=$\frac{△c}{△t}$=$\frac{(1-0.25)mol/L}{10min-0min}$=0.075mol/L•min,则v(H2)=3v(CO2)=3×0.075mol/L•min=0.225mol/(L•min)-1,
故答案为:0.225;
③A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
(2)①A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应,故A正确;
B、△H-T△S<0的反应能够自发进行,该反应的△H>0,若能够自发进行△S必须小大于0,故B错误;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=$\frac{0.05}{.05×0.{1}^{2}}$=100,故C正确;
D、工业上采用稍高的压强(5MPa)和250℃,是从转化率和反应速率两方面综合考虑,故D错误;
故选AC;
②A.充入CO,使体系总压强增大,但一氧化碳本身转化率降低,故A不选;
B.将CH3OH(g)从体系中分离,平衡正向移动,一氧化碳的转化率增大,故B选;
C.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,一氧化碳的转化率不变,故C不选;
D.使用高效催化剂,反应速率加快,但平衡不移动,一氧化碳的转化率不变,故D不选;
故选B.
点评 本题考查了化学平衡影响因素分析判断,平衡常数概念的计算应用,掌握基础是关键,题目难度中等.

| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.086 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L、M、R、T形成的简单离子的半径最大的是L | |
| B. | 单质与等浓度等体积的稀盐酸反应的速率为Q>L | |
| C. | 气态氢化物稳定性:R>T | |
| D. | M与T形成的化合物既能与强酸反应又能与强碱反应 |
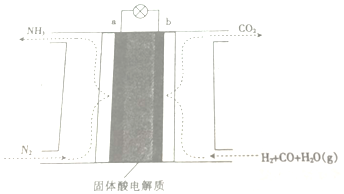
| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |
I.实验室制备FeBr2
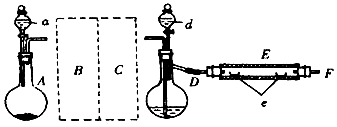
实验室用如图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中盛有细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在E管的一端有黄绿色鳞片状溴化亚铁.
请回答:
(1)仪器D的名称是蒸馏烧瓶.给D加热最好选择下列加热器中的b.

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为盛有饱和NaHCO3溶液的洗气瓶,C为盛有浓H2SO4的洗气瓶.为防止污染空气,实验时应在F处连接盛有碱性溶液的尾气吸收装置.
(3)实验时,装置D和E的橡胶塞最好用铝箔包住,且连接D、E之间的橡胶管尽可能短的原因是Br2有腐蚀性,腐蚀橡胶塞.
(4)①E管反应前先通入一段时间CO2,其主要作用是排净容器里的空气;
②反应过程中要继续通入CO2,其主要作用是将Br2蒸气带入反应器中.
II.探究FeBr2的还原性
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
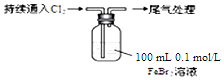 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(6)若向上述FeBr2溶液中通入224mL Cl2(标准状况),则反应的离子方程式为2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
| A. | 合成酚醛树脂的单体是苯酚和甲醇 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | 塑料、合成纤维和合成橡胶都属于合成材料 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
 根据所学知识完成下列填空.
根据所学知识完成下列填空.