题目内容
15.在SO2+Cl2+2H2O═H2SO4+2HCl的中,Cl2是氧化剂,SO2是还原剂,被氧化的物质是SO2,被还原的物质是Cl2,转移的电子数目是2e-.分析 含元素化合价升高的物质为还原剂,该元素在反应中被氧化;含元素化合价降低的物质为氧化剂,该元素在反应中被还原;根据S元素的化合价变化来计算转移电子的物质的量.
解答 解:在SO2+Cl2+2H2O=H2SO4+2HCl反应中,S元素的化合价由+4价升高为+6价,Cl元素的化合价由0降低为-1价,则SO2为还原剂,被氧化,Cl2为氧化剂,被还原,转移的电子数目是2e-,故答案为:Cl2;SO2;SO2;Cl2;2e-.
点评 本题考查氧化还原反应,明确反应中的基本概念,并学会利用元素的化合价来分析氧化剂、还原剂、计算转移的电子数,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
5.下列离子方程式中正确的是( )
| A. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca 2+=CaCO3↓ | |
| B. | 硝酸银溶液与食盐水的反:Ag++Cl-=AgCl↓ | |
| C. | 锌与盐酸的反应:Zn+2H++2Cl -=Zn 2++2Cl-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe 3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ |
3.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法不正确的是( )
| A. | W、Y、R的简单离子半径依次增大 | |
| B. | X、R、Z都可与Y形成两种化合物 | |
| C. | X2Y的热稳定性强于X2R、沸点也高于X2R,但解释的理由不相同 | |
| D. | Z元素分别与X元素和Y元素形成的化合物都是离子晶体,均能与水反应且一定生成了强碱和无色气体 |
20.下列关于氯气的叙述正确的是( )
| A. | 钠在氯气中燃烧产生白色烟雾 | |
| B. | 红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾 | |
| C. | 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰 | |
| D. | 氯气可用于漂白,这是氯气的漂白作用 |
7. (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
4.胃酸的主要成分是( )
| A. | 盐酸 | B. | 醋酸 | C. | 硫酸 | D. | 硝酸 |
6.下列各化合物的命名中正确的是( )
| A. | CH2=CH-CH=CH2 1,4-丁二烯 | B. |  3-丁醇 3-丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-甲基丁烷 2-甲基丁烷 |
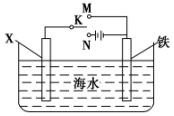 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.