题目内容
18.化学与生活、社会密切相关.下列说法正确的是( )| A. | 合成酚醛树脂的单体是苯酚和甲醇 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | 塑料、合成纤维和合成橡胶都属于合成材料 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
分析 A.酚醛树脂的单体是苯酚和甲醛;
B.乙烯为石油裂解产品;
C.合成纤维是由人工合成方法制得的,生产不受自然条件的限制;
D.电解质是指:在水溶液或熔化状态下都能导电的化合物.
解答 解:A.工业用苯酚与甲醛制备酚醛树脂,苯酚与甲醇不反应,故A错误;
B.乙烯为裂解产品,石油分馏得到的产品含汽油,故B错误;
C.三大合成材料指的是塑料、合成纤维、合成橡胶,故C正确;
D.蔗糖水解生成单糖,淀粉水解生成葡萄糖,油脂水解生成甘油,葡萄糖、甘油均为非电解质,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的关系,题目难度不大.

练习册系列答案
相关题目
7.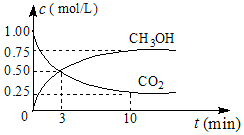 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
8.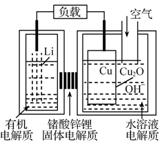 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
6.下列各化合物的命名中正确的是( )
| A. | CH2=CH-CH=CH2 1,4-丁二烯 | B. |  3-丁醇 3-丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-甲基丁烷 2-甲基丁烷 |
13.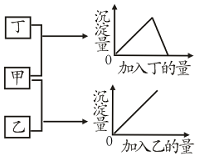 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )| A. | Al2(SO4)3 | B. | NaOH | C. | FeSO4 | D. | BaCl2 |
3.化学与生产、生活、科技等密切相关,下列说法不正确的是( )
| A. | 加大清洁能源的开发利用,提髙资源的利用率 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 用沼气、太阳能、风能等新型能源代替化石燃料 |
10.下列根据实验操作和现象所得到的结论正确的是.
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
8.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增a g,则该物质为( )
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
