题目内容
19. 根据所学知识完成下列填空.
根据所学知识完成下列填空.(1)鉴别真假羊毛衫的方法是先取样,再灼烧,若有烧焦羽毛气味,则为真羊毛衫
(2)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝.其中属于解热镇痛的药物是阿司匹林 ,青霉素的作用是能抑制某些微生物的生长,杀灭某些微生物
(3)药片常用淀粉作粘合剂,淀粉水解的最终产物是葡萄糖
(4)材料是人类赖以生存与发展的重要物质基础,是时代进步的重要标志.
(1)以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池
d.废报纸 e.尼龙绳 f.轮胎 g.铁锅
请用相应的字母填空:
①用无机非金属材料制作的是a
②用合成高分子材料中橡胶制作的是f
③随意丢弃会对水体和土壤都造成污染的是c
④如右图所示,物品d可投入A(填“A”或“B”)标志的垃圾桶中.
分析 (1)羊毛的成分是蛋白质,依据蛋白质灼烧产生特殊气味解答;
(2)阿司匹林属于解热镇痛的药物;青霉素的作用是消炎;
(3)淀粉为多糖,水解的最终产物是葡萄糖;
(4)a.玻璃杯是由玻璃制成,玻璃为硅酸盐材料;
b.电源插座材料是酚醛树脂,是高分子材料中的塑料;
c.废旧干电池,含的少量的重金属,如铅、汞、镉对人体有毒,随意丢弃会对水体和土壤都造成污染;
d.废报纸,主要材料为纤维素,可以回收利用;
e.尼龙绳属于高分子材料,属于合成纤维;
f.轮胎属于高分子材料中的橡胶;
g.铁锅为铁合金,含有杂质碳在电解质环境下,已发生电化学腐蚀;
依据各种物质的材料和成分的性质分析解答.
解答 解:(1)羊毛的主要成分为蛋白质,燃烧时有烧焦羽毛的气味,鉴别真假羊毛衫的方法是先取样,再抽丝,在酒精灯上燃烧,如果有烧焦羽毛的味道,说明是真羊毛衫,否则为假的;
故答案为:灼烧,若有烧焦羽毛气味,则为真羊毛衫;
(2)阿司匹林属于解热镇痛的药物;青霉素为一种消炎药,能抑制某些微生物的生长,杀灭某些微生物;氢氧化铝、碳酸镁可与胃酸中的盐酸反应,从而可以治疗胃酸过多,
故答案为:阿司匹林;能抑制某些微生物的生长,杀灭某些微生物;
(3)淀粉为多糖,水解的最终产物是葡萄糖,
故答案为:葡萄糖;
(4)①玻璃杯是由玻璃制成,玻璃为硅酸盐材料,
故答案为:a;
②轮胎属于高分子材料中的橡胶,
故答案为:f;
③废旧干电池,含的少量的重金属,如铅、汞、镉对人体有毒,随意丢弃会对水体和土壤都造成污染,
故答案为:c;
④废报纸为可回收资源,应放入可回收自由的垃圾桶中,A为可回收标志,B为不可回收垃圾,所以A符合,
故答案为:A.
点评 本题考查了生活中常见的有机物、药物的主要成分和疗效等知识,题目综合性强,涉及知识广泛,注意相关基础知识的积累,题目难度不大.

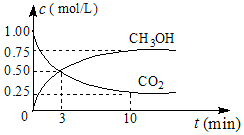 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C.
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) $\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳能催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从0min到10min,v(H2)=0.225mol•(L•min)-1
②能说明上述反应达到平衡状态的是D.
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(2)工业上,CH3OH也可由CO和H2合成:CO(g)+2H2(g)?CH3OH(g).
①参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,在高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2.达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
②若容器容积不变,则下列措施可提高反应CO转化率的是B.
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂.
①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解.
则下列结论不正确的是( )
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |
| A. | 盐酸 | B. | 醋酸 | C. | 硫酸 | D. | 硝酸 |
| A. |  实验室中制取少量乙酸乙酯 | B. |  比较非金属性S>C>Si | ||
| C. |  处理尾气 | D. |  闭合开关K形成原电路 |
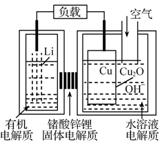 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |

 ;
;