题目内容
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
考点:离子共存问题
专题:
分析:A.使pH试纸显蓝色的溶液,显碱性;
B.与铝粉反应放出氢气的无色溶液,为强碱或非强氧化性酸溶液;
C.使红色石蕊试纸变蓝的溶液,显碱性;
D.pH=0的溶液,显酸性,离子之间结合生成弱电解质.
B.与铝粉反应放出氢气的无色溶液,为强碱或非强氧化性酸溶液;
C.使红色石蕊试纸变蓝的溶液,显碱性;
D.pH=0的溶液,显酸性,离子之间结合生成弱电解质.
解答:
解:A.使pH试纸显蓝色的溶液,显碱性,不能大量存在Cu2+、Fe3+,故A错误;
B.与铝粉反应放出氢气的无色溶液,为强碱或非强氧化性酸溶液,碱溶液中不能存在Al3+,故B错误;
C.使红色石蕊试纸变蓝的溶液,显碱性,该组离子之间不反应,与氢氧根离子也都不反应,能大量共存,故C正确;
D.pH=0的溶液,显酸性,H+、ClO-离子之间结合生成弱电解质,不能大量共存,故D错误;
故选C.
B.与铝粉反应放出氢气的无色溶液,为强碱或非强氧化性酸溶液,碱溶液中不能存在Al3+,故B错误;
C.使红色石蕊试纸变蓝的溶液,显碱性,该组离子之间不反应,与氢氧根离子也都不反应,能大量共存,故C正确;
D.pH=0的溶液,显酸性,H+、ClO-离子之间结合生成弱电解质,不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存,为高频考点,把握离子之间的反应及习题信息的抽取为解答的关键,侧重复分解及氧化还原反应的考查,题目难度不大.

练习册系列答案
相关题目
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
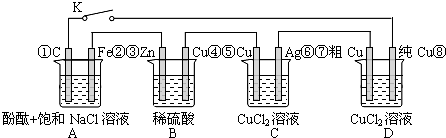

| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
现有装有物质的量浓度为1.2mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲、乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A、1.08克 |
| B、1.44克 |
| C、1.8 克 |
| D、无法计算 |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
图中仪器使用或操作正确的是( )
| A | B | C | D |
| 制备氢氧化铝 | 加热碳酸氢钠固体 | 排空气法收集NH3、Cl2、NO、CO2等气体 | 配制100mL 0.1000mol?L-1 NaOH溶液 |
 |
 |
 |
 |
| A、A | B、B | C、C | D、D |
下列相关反应的离子方程式书写正确的是( )
| A、浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | ||
| B、钠与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | ||
| C、向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | ||
D、将铜片放入足量稀硝酸中:3Cu+8H++2NO
|
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题: 某装置如图所示,该装置工作过程中,下列判断错误的是( )
某装置如图所示,该装置工作过程中,下列判断错误的是( )