题目内容
图中仪器使用或操作正确的是( )
| A | B | C | D |
| 制备氢氧化铝 | 加热碳酸氢钠固体 | 排空气法收集NH3、Cl2、NO、CO2等气体 | 配制100mL 0.1000mol?L-1 NaOH溶液 |
 |
 |
 |
 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,药品的取用,物质的溶解与加热,气体的收集,配制一定物质的量浓度的溶液
专题:实验评价题
分析:A.氨水与硫酸铝反应生成氢氧化铝,氨水过量时沉淀不溶解;
B.加热碳酸氢钠固体,试管口应向下倾斜;
C.NO不能利用排空气法收集;
D.配制100mL应选100mL容量瓶.
B.加热碳酸氢钠固体,试管口应向下倾斜;
C.NO不能利用排空气法收集;
D.配制100mL应选100mL容量瓶.
解答:
解:A.氨水与硫酸铝反应生成氢氧化铝,氨水过量时沉淀不溶解,则装置合理,故A正确;
B.加热碳酸氢钠固体,试管口应向下倾斜,该反应中生成水,装置不合理,故B错误;
C.NO不能利用排空气法收集,导管长进短出收集密度比空气大的气体,导管短进长出收集密度比空气小的气体,故C错误;
D.配制100mL应选100mL容量瓶,不能使用量筒、烧瓶精确配制100mL0.1000mol?L-1 NaOH溶液,故D错误;
故选A.
B.加热碳酸氢钠固体,试管口应向下倾斜,该反应中生成水,装置不合理,故B错误;
C.NO不能利用排空气法收集,导管长进短出收集密度比空气大的气体,导管短进长出收集密度比空气小的气体,故C错误;
D.配制100mL应选100mL容量瓶,不能使用量筒、烧瓶精确配制100mL0.1000mol?L-1 NaOH溶液,故D错误;
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及氢氧化铝的制备、气体的制取和收集、溶液的配制等,侧重反应原理及物质性质的考查,注意实验方案的评价性、合理性、操作性及可行性考查,题目难度不大.

练习册系列答案
相关题目
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)2Cl].下列化合物属于混盐的是( )
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
用NA代表阿伏加德罗常数.下列说法正确的是( )
| A、9g重水(D2O)中所含质子数为0.5×6.02×1023 |
| B、电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
| C、往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
| D、VL a mol?L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
电化学降解法可用于治理水中硝酸盐的污染.降解NO3-的原理如图所示.下列说法不正确的是( )

| A、直流电源A为正极、B为负极 |
| B、当电解过程中质子从Pt电极向Ag-Pt电极移动 |
| C、在阳极发生的电极反应:2H2O-4e-=O2+4H+ |
| D、当电解过程转移2mol电子时,阴极室质量减少5.6g |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、1.8g NH4+ 所含质子数为NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4 L |
| C、物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl-个数为NA |
| D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A、饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-) |
| B、pH=4的醋酸中:c(H+)=1.0×10-4mol?L-1 |
| C、0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
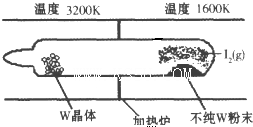 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.