题目内容
现有装有物质的量浓度为1.2mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲、乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A、1.08克 |
| B、1.44克 |
| C、1.8 克 |
| D、无法计算 |
考点:化学方程式的有关计算
专题:计算题
分析:甲中Al与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,HCl的物质的量=1.2mol/L×0.1l=0.12mol,乙中Al与稀硫酸发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,硫酸的物质的量=1mol/L×0.1l=0.1mol,若Al都完全反应生成氢气体积应相等,若酸都完全反应,由方程式可知,甲、乙得到氢气体积之比=0.12mol×
:0.1mol=3:5,而实际甲、乙得到氢气的体积比为3:4,故与盐酸反应Al有剩余,与硫酸反应Al完全反应,根据HCl计算甲中生成氢气的物质的量,进而计算乙中生成氢气的物质的量,再根据乙中方程式计算Al的质量.
| 1 |
| 2 |
解答:
解:甲中Al与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,HCl的物质的量=1.2mol/L×0.1L=0.12mol,乙中Al与稀硫酸发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,硫酸的物质的量=1mol/L×0.1L=0.1mol,若Al都完全反应生成氢气体积之比应为1:1,若酸都完全反应,由方程式可知,甲、乙得到氢气体积之比=0.12mol×
:0.1mol=3:5,而实际甲、乙得到氢气的体积比为3:4,由于硫酸提供的H+0.2mol比盐酸提供的H+0.1mol要多,故三者的反应情况应该是:与盐酸反应Al有剩余,与硫酸反应Al完全反应,硫酸过量
甲中生成氢气的物质的量=0.12mol×
=0.06mol,故乙中生成氢气的物质的量=0.06mol×
=0.08mol,设加入的铝的质量为m,
则:2Al+3H2SO4=Al2(SO4)3+3H2↑
54g 3mol
m 0.08mol
m=
=1.44g
故选B.
| 1 |
| 2 |
甲中生成氢气的物质的量=0.12mol×
| 1 |
| 2 |
| 4 |
| 3 |
则:2Al+3H2SO4=Al2(SO4)3+3H2↑
54g 3mol
m 0.08mol
m=
| 54g×0.08mol |
| 3mol |
故选B.
点评:本题考查化学方程式的有关计算,判断Al与盐酸、硫酸反应的过量问题是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与技术、社会和环境密切相关.下列说错误的是( )
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能源 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、充分开发利用天然纤维,停止使用各种化学合成材料 |
| D、加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率 |
下列各组离子在指定环境中一定能大量共存的是( )
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
下列离子在指定溶液中一定能大量共存的是( )
| A、碱性溶液中:Na+、K+、SO32-、S2- |
| B、无色溶液中:Na+、Fe3+、Cl-、SO42- |
| C、无色溶液中:Na+、K+、HCO3-、AlO2- |
| D、酸性溶液中:Na+、K+、NO3-、ClO- |
用NA代表阿伏加德罗常数.下列说法正确的是( )
| A、9g重水(D2O)中所含质子数为0.5×6.02×1023 |
| B、电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
| C、往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
| D、VL a mol?L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |

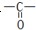 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)