题目内容
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(1)C、Si、N元素的电负性由大到小的顺序是 .C60和金刚石都是碳的同素异形体,二者相比较熔点较高的是 .
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式: .
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,d轨道全满或全空时,无颜色;反之,则有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+ 颜色.(填“无”或“有”)
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2分子的结构式为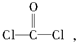 每个COCl2分子内含有
每个COCl2分子内含有
A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键 D.3个σ键、1个π键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中断裂的化学键只有配位键,形成的化学键是 .
(5)已知FexO晶体的晶胞结构为NaCl型,由于晶体缺陷x的值小于1.测知FexO晶体密度为a g/cm3 晶胞边长为b nm.求x的值(列出方程式即可) .
(1)C、Si、N元素的电负性由大到小的顺序是
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2分子的结构式为
 每个COCl2分子内含有
每个COCl2分子内含有A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键 D.3个σ键、1个π键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中断裂的化学键只有配位键,形成的化学键是
(5)已知FexO晶体的晶胞结构为NaCl型,由于晶体缺陷x的值小于1.测知FexO晶体密度为a g/cm3 晶胞边长为b nm.求x的值(列出方程式即可)
考点:配合物的成键情况,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,晶胞的计算
专题:化学键与晶体结构
分析:(1)根据元素的电负性在周期表中的递变规律判断C、Si、N元素的电负性由大到小的顺序;根据晶体的类型与熔沸点的关系判断C60和金刚石的熔点高低;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(3)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(4)①共价单键是σ键,共价双键中一个是σ键一个是π键;
②根据生成物判断形成的化学键;
(5)根据晶胞结构、晶胞的密度和晶胞边长列出用x表示的方程式.
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(3)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(4)①共价单键是σ键,共价双键中一个是σ键一个是π键;
②根据生成物判断形成的化学键;
(5)根据晶胞结构、晶胞的密度和晶胞边长列出用x表示的方程式.
解答:
解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>C>Si,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔沸点远大于分子晶体,
故答案为:N>C>Si;金刚石;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,
故答案为:有;
(4)①C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以D正确,
故答案为:D;
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:金属键;
(5)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,bnm=1×10-7cm,根据ρ=
得:a=
,整理可得:(56x+16)×4=a(b×10-7)3NA,
故答案为:(56x+16)×4=a(b×10-7)3NA.
故答案为:N>C>Si;金刚石;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,
故答案为:有;
(4)①C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以D正确,
故答案为:D;
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:金属键;
(5)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,bnm=1×10-7cm,根据ρ=
| m |
| V |
| ||
| (b×10-7)3 |
故答案为:(56x+16)×4=a(b×10-7)3NA.
点评:本题考查较为综合,涉及多个方面的知识,题目难度较大,本题注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目

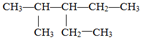 的名称是
的名称是
 (1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.
(1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.