题目内容
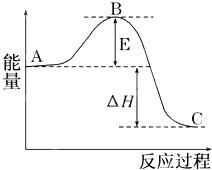 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.请回答下列问题:
(1)图中A、C分别表示
(2)图中反应是
(3)如果反应速率v(SO2)为0.05mol/(L?min),
则v(O2)=
(4)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3mol SO3(g)的△H(要求计算过程).
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)反应速率之比等于化学计量数之比;
(4)利用燃烧热的概念以及盖斯定律进行计算.
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)反应速率之比等于化学计量数之比;
(4)利用燃烧热的概念以及盖斯定律进行计算.
解答:
解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,催化剂能降低反应的活化能,加快化学反应速率,
故答案为:反应物总能量;生成物总能量;无影响;催化剂能降低反应的活化能,加快化学反应速率;
(2)根据图示知道,反应物的能量高于生成物的能量,该反应是放热反应,反应需要在高温下才能发生,故答案为:放热;需要;
(3)反应速率之比等于化学计量数之比,则υ(O2)=
υ(SO2)=
×0.05mol?L-1?min-1=0.025mol?L-1?min-1,υ(SO2)=υ(SO3)
故答案为:0.025;0.05;
(4)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
O2(g)=SO3(g)△H2=-99 KJ?mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+
O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 KJ?mol-1,
答:已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
O2(g)=SO3(g)△H2=-99 KJ?mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+
O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 KJ?mol-1.
故答案为:反应物总能量;生成物总能量;无影响;催化剂能降低反应的活化能,加快化学反应速率;
(2)根据图示知道,反应物的能量高于生成物的能量,该反应是放热反应,反应需要在高温下才能发生,故答案为:放热;需要;
(3)反应速率之比等于化学计量数之比,则υ(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.025;0.05;
(4)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
| 1 |
| 2 |
则利用盖斯定律将①×3+②×3可得3 S(s)+
| 9 |
| 2 |
答:已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
| 1 |
| 2 |
则利用盖斯定律将①×3+②×3可得3 S(s)+
| 9 |
| 2 |
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.
 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
 和一个-Cl,它的可能结构分别是
和一个-Cl,它的可能结构分别是