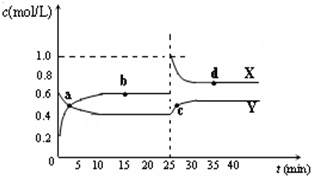
题目内容
4.(1)利用化学反应可以制备许多物质,实验室用铜制备NO2的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.(2)工业上,黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法熔炼工
艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O═6Cu+SO2↑.该反应中还原剂为Cu2S (填化学式),每生成1mol Cu,反应中转移电子的物质的量为1mol.
(3)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤. ②将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3. 据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了[Al(OH)4]-或AlO2-(写离子).
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水所选试剂为稀硫酸、酸性KMnO4溶液.证明炉渣中含有FeO的实验现象为用稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色.
分析 (1)Cu与浓硝酸反应制备二氧化氮;
(2)Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高;
(3)炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,加盐酸溶液后,过滤分离出SiO2,滤液中含铁离子、亚铁离子和铝离子,将亚铁离子氧化后加NaOH足量,过滤分离出氢氧化铁,煅烧得Fe2O3,结合亚铁离子具有还原性及发生的反应来解答.
解答 解:(1)①Cu与浓硝酸反应制备二氧化氮,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高,则还原剂为Cu2S,由反应即Cu元素的化合价变化可知生成6molCu转移6mol电子,则每生成1mol Cu,反应中转移电子的物质的量为1mol,故答案为:Cu2S;1mol;
(3)炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,加盐酸溶液后,过滤分离出SiO2,滤液中含铁离子、亚铁离子和铝离子,将亚铁离子氧化后加NaOH足量,过滤分离出氢氧化铁,煅烧得Fe2O3,结
a.上述②中NaOH过量,氢氧化铝可溶于强碱溶液中,则炉渣中的Al2O3变成[Al(OH)4]- 或AlO2-,故答案为:[Al(OH)4]- 或AlO2-;
b.因亚铁离子具有还原性,能使高锰酸钾褪色,则选择试剂为稀硫酸、酸性KMnO4溶液,实验验证炉渣中含有FeO的现象为用稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色,
故答案为:稀硫酸、酸性KMnO4溶液;用稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色.
点评 本题考查物质的制备及氧化还原反应,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应应用及物质检验等,题目难度不大.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 石油的分馏和煤的气化、液化都是物理变化 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 分子式为C4H9Cl的同分异构体有2种 | |
| D. | 聚乙烯、丙炔、裂化汽油都可以使溴水褪色 |
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2.
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性强(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键.
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+. | A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| A. | 温度 | B. | 物质的量浓度 | C. | 规格 | D. | 刻度线 |
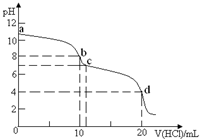 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |