题目内容
14.现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍.M原子的M能层上有4个未成对电子.请完成下列问题:(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序(用元素符号表示)F>N>O>C.
(2)M原子的基态电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2.
(3)根据VESPR理论,推断出由W与X两元素组成的最简单二价阴离子的空间构型为平面三角形,W原子的杂化类型为sp2杂化.
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低顺序为(用化学式表示):H2O>HF>NH3>CH4.
(5)WX2晶体的晶胞中最近的两微粒之间的距离(设晶胞棱长为a)是$\frac{\sqrt{2}}{2}$a.
(6)某蓝色晶体,其特征是M2+、M3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个WZ-.第三周期与冷水可以反应的金属元素R的离子位于立方体的恰当位置上.
①根据特征可知该晶体的化学式(用最简整数表示)为:KFe2(CN)6.
②该立方体否(填“是”或“否”)属于该物质的晶胞,R的离子在晶体中的位置是Na+位于每间隔一个立方体的体心.
分析 W的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故W为C;W、Z、X、T、Y五种非金属元素原子半径依次减小,故Z为N、X为O、T为F、Y为H;M原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,则M为Fe.
(1)同周期主族元素,从左到右元素的第一电离能呈增大趋势,但是氮原子的2p轨道上电子半充满,较稳定,第一电离能比氧的大;
(2)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
(3)W与X两元素组成的最简单二价阴离子为CO32-,计算C原子孤电子对数、价层电子对数,确定空间构型与杂化方式;
(4)相对分子质量越大,分子间作用力越强,沸点越高,含有氢键增大沸点,结合物质的状态判断;
(5)CO2晶体为面心六方密堆积,晶胞面对角线上的CO2相邻;
(6)①第三周期与冷水可以反应的金属元素R为Na,根据均摊法计算立方体中Fe2+、Fe3+、CN-数目,根据电中性确定Na+数目,进而确定化学式;
②一般情况下晶胞都是平行六面体,整块晶体可以看成是无数晶胞无隙并置而成的.
解答 解:W的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故W为C;W、Z、X、T、Y五种非金属元素原子半径依次减小,故Z为N、X为O、T为F、Y为H;M原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,则M为Fe.
(1)同周期主族元素,从左到右元素的第一电离能呈增大趋势,但是氮原子的2p轨道上电子半充满,较稳定,第一电离能比氧的大,故第一电离能由大到小的顺序为:F>N>O>C,
故答案为:F>N>O>C;
(2)M为Fe元素,其原子序数为26,其基态原子核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(3)W为C、X为O元素,W与X两元素组成的最简单二价阴离子为CO32-,CO32-的中C原子价层电子对数=3+$\frac{4+2-2×3}{2}$=3,所以C原子采取sp2杂化,C原子没有最外层不存在未成键电子对,所以CO32-的空间构型为平面三角形,
故答案为:平面三角形;sp2杂化;
(4)Y与T、X、Z、W所形成的最简单化合物分别为HF、H2O、NH3、CH4,由于HF、H2O、NH3中存在氢键,所以CH4的沸点最低;常温下水为气态,氟化氢和氨气为气态,则水的沸点最高,HF相对分子质量大于氨气,HF分子间作用力更强,HF的沸点大于氨气,所以四种气体的沸点大小为:H2O>HF>NH3>CH4,
故答案为:H2O>HF>NH3>CH4;
(5)CO2晶体为面心六方密堆积,晶胞面对角线上的CO2相邻,设晶胞棱长为a,最近的两微粒之间的距离是$\frac{\sqrt{2}}{2}$a,
故答案为:$\frac{\sqrt{2}}{2}$a;
(6)①第三周期与冷水可以反应的金属元素R为Na,立方体中Fe原子有8×$\frac{1}{8}$=1个,Fe2+、Fe3+离子各占一半,总电荷为+2.5,CN-为12×$\frac{1}{2}$=3,所带电荷为-3,根据电中性知Na+应是0.5个,故化学式为:NaFe2(CN)6,
故答案为:NaFe2(CN)6;
②一般情况下晶胞都是平行六面体,整块晶体可以看成是无数晶胞无隙并置而成的,Fe2+、Fe3+离子分别占据立方体互不相邻的顶点,该立方体不是晶胞,每两个立方体内有一个Na+离子,则Na+位于每间隔一个立方体的体心,
故答案为:否;Na+位于每间隔一个立方体的体心.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型判断、沸点比较、晶胞结构及计算等,熟记中学常见晶胞结构,(6)中注意利用电荷守恒确定钠数目,钠离子位置确定为易错点,需要学生具备一定的空间现象.

| A. | 它的原子最外层有4个电子 | |
| B. | 它具有+2、+4价 | |
| C. | 金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质 | |
| D. | 它的金属性比铅强 |
| A. |  属于酯类 属于酯类 | B. | 乙醛的结构简式为CH3COH | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 苯的实验式为C6H6 |
| A. | v(A)=0.25mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.3mol/(L•min) | D. | v(D)=0.1mol/(L•min) |
| A. | 二茂铁属于离子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 己知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | 二价铁离子的基态电子排布式为:[Ar]3d44s2 |
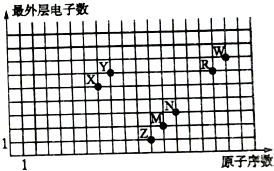
| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | 气态氢化物的稳定性:X>Y>R>W | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的外围电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是④ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素X的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X2+ |
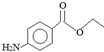 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |