题目内容
16.已知:2NO2(g)?N2O4(g)△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.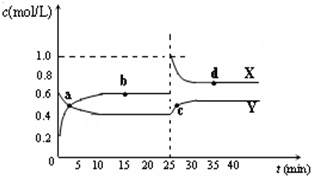
(1)a、b、c、d四个点中,化学反应处于平衡状态的是b、d 点.
(2)25min时,增加了NO2(填物质的化学式)0.8mol.
(3)a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是cdba (填字母).
分析 由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,
(1)根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
(2)c(NO2)瞬间增大,比平衡状态增加了(1-0.6)×2=0.8mol,增大c(NO2)平衡向生成N2O4方向移动;
(3)c(NO2)越大,颜色越深.
解答 解:由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
(1)由图知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d;
(2)25min时,c(NO2)瞬间增大,比平衡状态增加了(1-0.6)×2=0.8mol 增大c(NO2),平衡向生成N2O4方向移动,故答案为:NO2;0.8;
(3)从a到b,c(NO2)增大,c点和d点分别是增大c(NO2)后未达到平衡的点和平衡时的点,所以c点c(NO2)大于d点,二氧化氮浓度越大颜色越深,故颜色由深到浅的顺序是cdba,故答案为:cdba.
点评 本题考查化学反应速率及化学平衡图象,注重对图象的分析,明确图象中纵横坐标及点、线、面的意义是解答本题的关键,难度不大.

| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的外围电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是④ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素X的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X2+ |
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氢氧化钠溶液与稀盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
| A. |  CuSO4溶液 | B. |  ZnSO4溶液 | ||
| C. |  酒精 | D. | 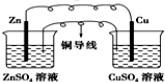 |
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
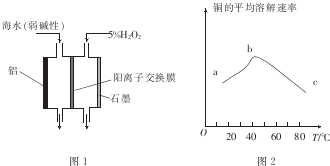
(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
②上表中V3=15.2.
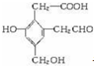 ,试回答:
,试回答: