题目内容
19.若阿伏加德罗常数的值为NA,则下列说法中正确的是( )| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
分析 A、标况三氧化硫为液体;
B、铁和氯气反应后变为+3价;
C、氧气和臭氧均由氧原子构成;
D、铜只能和浓硫酸反应,和稀硫酸不反应.
解答 解:A、标况三氧化硫为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、铁和氯气反应后变为+3价,故1mol铁失去3NA个电子,故B错误;
C、氧气和臭氧均由氧原子构成,故3.2g氧气和3.2g臭氧中含有的氧原子的物质的量均为0.2mol,即0.2NA个,故C正确;
D、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.二茂铁[(C5H5) 2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,已知:二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.下列说法正确的是( )
| A. | 二茂铁属于离子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 己知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | 二价铁离子的基态电子排布式为:[Ar]3d44s2 |
10.使用前不需检查是否漏液的仪器是( )
| A. | 容量瓶 | B. | 分液漏斗 | C. | 酸式滴定管 | D. | 蒸馏烧瓶 |
14.氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.下列说法正确的是( )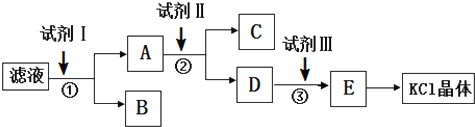

| A. | 起始滤液的pH=7 | |
| B. | 步骤②中加入试剂 II的目的是除去CO32- | |
| C. | 试剂 I为Ba(NO3)2溶液 | |
| D. | 试剂Ⅲ为稀盐酸 |
11.下列离子方程式书写不正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氢氧化钠溶液与稀盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
8.下列说法正确的是( )
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
9.鉴别乙醛溶液和乙醇溶液,使用的试剂是( )
| A. | 金属钠 | B. | 浓硫酸 | C. | 银氨溶液 | D. | 氢氧化钠 |
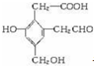 ,试回答:
,试回答: