题目内容
7. 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题:(1)下列有关实验叙述正确的是bc(填序号).
a.试管、烧杯、量筒、集气瓶均不能用酒精灯直接加热
b.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中
c.湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,最终其颜色褪去
d.配制稀硫酸时,先沿烧杯内壁缓缓注入浓硫酸,再向烧杯中缓缓加水
e.称量NaOH固体时,须在两个托盘上放上大小相同的纸片
(2)实验室需用480mL 0.1mol•L-1标准NaOH溶液.请回答下列问题:
①在如图所示仪器中,配制上述溶液肯定不需要的是AC(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有500ml容量瓶 小烧杯 玻璃棒.
②配制NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为2.0g.
b.称取氢氧化钠固体.
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中.
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,并冷却至室温.
e.盖好瓶塞,上下反复颠倒7~8次,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.上述步骤的正确操作顺序为abdcfe(用序号表示).
分析 (1)a试管可以直接加热;
b钠性质活泼,密度大于煤油;
c氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性;
d依据浓硫酸稀释正确顺序;
e氢氧化钠具有腐蚀性,称量应放在小烧杯或者称量瓶中进行;
(2)①依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
②依据m=CVM计算需要溶质的质量;依据配制一定物质的量浓度溶液的一般步骤排序.
解答 解:(1)a烧杯、量筒、集气瓶均不能用酒精灯直接加热,试管可以直接加热,故a不选;
b钠性质活泼,密度大于煤油,钠保存煤油或石蜡油中可以隔绝空气,故b选;
c湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以最终其颜色褪去,故c选;
d浓硫酸密度大于水,稀释时应将浓硫酸缓缓加入到水中,故d不选;
e氢氧化钠具有腐蚀性,称量应放在小烧杯或者称量瓶中进行,故e不选;
故选:bc;
(2)①配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平(含砝码)、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,用不到的仪器:平底烧瓶和分液漏斗,还缺少的仪器:500ml容量瓶 小烧杯 玻璃棒;
故答案为:AC 500ml容量瓶 小烧杯 玻璃棒;
②需用480mL 0.1mol•L-1标准NaOH溶液,应选择500mL容量瓶,需要溶质的质量m=0.5L×0.1mol/L×40g/mol=2.0g;
配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,所以正的顺序为:abdcfe;
故答案为:2.0;abdcfe.
点评 本题考查了配制一定物质的量浓度的溶液的方法,掌握配制一定物质的量浓度的溶液的原理及操作步骤是解题关键,题目难度不大,侧重考查学生基础实验能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
5.常温下,浓度均为0.1mol•L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别缴入NaOH固体,lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
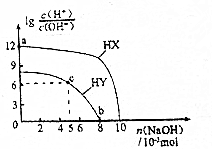

| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
2.在密闭容器中进行X2(g)+Y2(g)?2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
19.粗铜中一般含有锌、铁、银、金等杂质.在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯铜电极质量增加了3.2g.在此过程中,下列说法正确的是( )

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
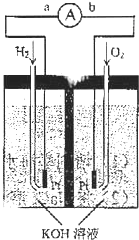 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: