题目内容
2.在密闭容器中进行X2(g)+Y2(g)?2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
分析 若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,若反应物X2完全转化时生成Z2为0.8mol/L,但可逆反应不能完全转化,以此来解答.
解答 解:若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,若反应物X2完全转化时生成Z2为0.8mol/L,但可逆反应不能完全转化,
则平衡时0<c(X2)<0.4mol/L,
0<c(Y2)<0.6mol/L,
0<c(Z2)<0.8mol/L,
故选D.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
13.下列表述符合化学事实的是( )
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
10.用含有少量银和锌的粗铜做阳极,纯铜作阴极,硫酸侗溶液作电解液,通电一段时间后,阳极质量减轻了6.4g,下列说法正确的是( )
| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
17.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA | |
| B. | 1molAlCl3跟水反应完全转化成氢氧化铝胶体后,生成胶体粒子的数目为1NA | |
| C. | 12g石墨晶体中含有碳碳键数目为2×6.02×1023 | |
| D. | 标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
7.乙烷与乙炔相比较,下列叙述不正确的是( )
| A. | 都能燃烧,生成二氧化碳和水 | |
| B. | 乙炔易发生加成反应,乙烷不能发生加成反应 | |
| C. | 都能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色 | |
| D. | 相同物质的量的乙烷和乙炔,完全燃烧时生成CO2量相同 |
4.下列元素的原子半径最小的是( )
| A. | N | B. | P | C. | Se | D. | Te |
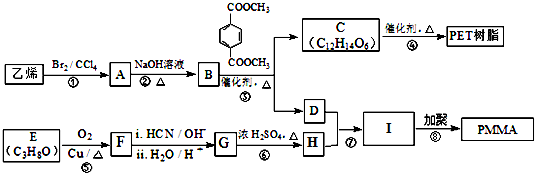
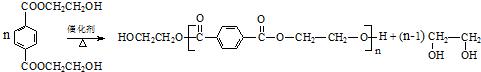
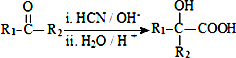 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)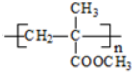 .
.
 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题: