题目内容
4.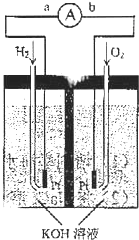 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是化学能转化为电能,在导线中电子流动方向 为由a到b(用a、b表示).
(2)负极反应式为H2+2OH--2e-=2H2O.
(3)电极表面镀铂粉的原因为增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本.
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH
Ⅱ.LiH+H2O═LiOH+H2↑
①已知LiH固体密度为 0.82g/cm3.用锂吸收 224L(标准状况)H2,生成的LiH体积 与被吸收的H2体积比为$\frac{1}{1120}$.
②由①生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为32mol.
分析 (1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极;
(2)碱性条件下,氢气失电子和氢氧根离子反应生成水;
(3)反应物接触面积越大,其反应速率越快;
(4)①根据氢气体积计算LiH的质量,再根据V=$\frac{m}{ρ}$计算LiH的体积;
②根据氢气中转移电子之间的关系式计算.
解答 解:(1)燃料电池中,化学能转化为电能,通入燃料的电极是负极、通入氧化剂的电极是正极,所以通入氢气的电极是负极,通入氧气的电极是正极,电子从负极沿导线流向正极,则电子流向由a到b,故答案为:化学能转化为电能;由a到b;
(2)碱性条件下,氢气失电子和氢氧根离子反应生成水,电极反应式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
(3)反应物接触面积越大,其反应速率越快,在电极表面镀铂粉,增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本,故答案为:增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本;
(4)①根据2Li+H2$\frac{\underline{\;加热\;}}{\;}$2LiH得生成LiH的质量=$\frac{224L}{22.4L}×2×8$g=160g,LiH的体积=$\frac{160g}{0.8g/c{m}^{3}}$=200cm3,氢气体积=224L=224000cm3,所以生成的LiH体积与被吸收的H2体积比=200cm3:224000cm3=$\frac{1}{1120}$,
故答案为:$\frac{1}{1120}$;
②由2Li+H2$\frac{\underline{\;加热\;}}{\;}$2LiH、LiH+H2O=LiOH+H2↑得若能量转化率为80%,则转化的氢气物质的量=$\frac{224L×80%}{22.4L/mol}$=8mol,最终生成氢气的物质的量是16mol氢气,则转移电子的物质的量=16mol×2=32mol,
故答案为:32mol.
点评 本题考查了原电池原理,涉及电极反应式的书写、电子流向的判断等知识点,根据得失电子确定正负极,再结合正负极上发生的反应来分析解答,易错点是(4)②,注意最终得到的氢气不仅包含原来的氢气还有水参与反应生成的氢气,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
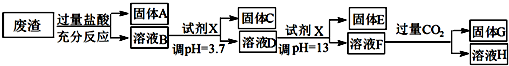
已知常温条件下:
①阳离子以氢氧化物形式完全沉淀(阳离子浓度低于10?5mol•L-1)时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
(2)上述流程中两次使用试剂X,推测试剂X是氢氧化钠(填“氨水”或“氢氧化钠”)其理由是经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性.
(3)写出F→H的反应离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全.
(5)固体C跟HI反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O.
(6)试计算Mg(OH)2的Ksp=10-11.
| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、Cl-、Rb+ |
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
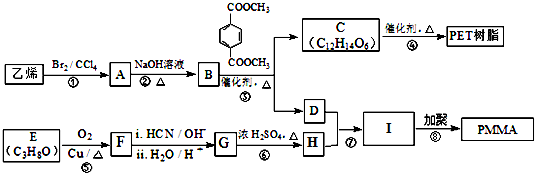
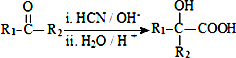 (R、R1、R2、R3均代表烃基)
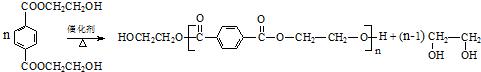
(R、R1、R2、R3均代表烃基)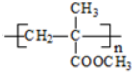 .
.
 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题: