题目内容
过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域.下图是以大理石(主要杂质Fe2O3)等为原料制取CaO2的流程:
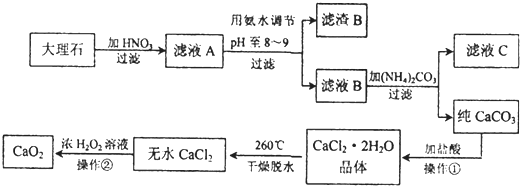
(1)操作①中应包括 (填序号).
A溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
请写CaCO3和稀盐酸反应的离子方程式: ;
(2)用氨水调节pH至8-9的目的: .
(3)若滤液C中c(CO
)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全.
[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)从滤液C中可回收得到的工业副产品的化学式为 .
(5)操作②的化学反应方程式: .

(1)操作①中应包括
A溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
请写CaCO3和稀盐酸反应的离子方程式:
(2)用氨水调节pH至8-9的目的:
(3)若滤液C中c(CO
2- 5 |
[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)从滤液C中可回收得到的工业副产品的化学式为
(5)操作②的化学反应方程式:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)实现固体和液体的分离采用过滤的方法,从氯化钙的溶液中获得氯化钙的结晶水合物要采用蒸发结晶的方法,碳酸钙能和强酸反应;
(2)pH至8-9范围段内时,三价铁可易形成沉淀;
(3)依据溶度积常数计算此时钙离子难度减小分析判断;
(4)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵;
(5)双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)实现固体和液体的分离采用过滤的方法,从氯化钙的溶液中获得氯化钙的结晶水合物要采用蒸发结晶的方法,碳酸钙能和强酸反应;
(2)pH至8-9范围段内时,三价铁可易形成沉淀;
(3)依据溶度积常数计算此时钙离子难度减小分析判断;
(4)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵;
(5)双氧水可以和氯化钙反应生成过氧化钙和盐酸.
解答:
解:根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)碳酸钙和硝酸铵的混合物过滤后,所得沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,CaCO3 和稀盐酸反应的实质是:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:ABE;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去);
(3)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;故答案为:是;
(4)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤所得滤液主要成分是硝酸铵,故答案为:NH4NO3;
(5)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,故答案为:CaCl2+H2O2=CaO2↓+2HCl.
(1)碳酸钙和硝酸铵的混合物过滤后,所得沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,CaCO3 和稀盐酸反应的实质是:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:ABE;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去);
(3)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;故答案为:是;
(4)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤所得滤液主要成分是硝酸铵,故答案为:NH4NO3;
(5)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,故答案为:CaCl2+H2O2=CaO2↓+2HCl.
点评:本题是一道物质分离和提纯的推断题,考查知识面较广,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
富勒烯是由60个碳原子构成的分子,碳原子成键情况与苯分子相似,由于它形似足球,所以又称足球烯.关于足球烯分子的叙述不正确的是( )
| A、一个分子中有12个五边形、20个六边形 |
| B、按凯库勒价键理论计算,12克足球烯可形成共价键的数目(共用电子对数)为1.5NA个 |
| C、按碳元素的四价理论计算,一个分子中有30个碳碳双键、60个碳碳单键 |
| D、N60分子与足球烯分子相似,每个氮原子的最外层电子数都满足8电子稳定结构 |
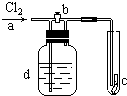 如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )| A、NaOH溶液 |
| B、浓H2SO4 |
| C、Ca(OH)2溶液 |
| D、食盐水 |
 如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )
如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )| A、甲为NaHCO3,乙为Na2CO3 |
| B、要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球 |
| C、加热不久就能看到A烧杯中的澄清石灰水变浑浊 |
| D、整个实验过程中A烧杯中的澄清石灰水无明显变化 |
