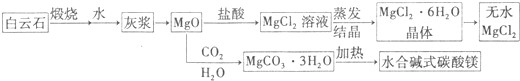
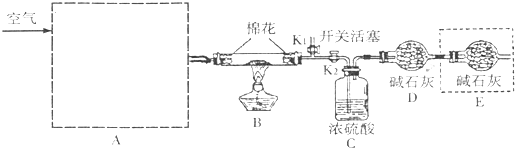
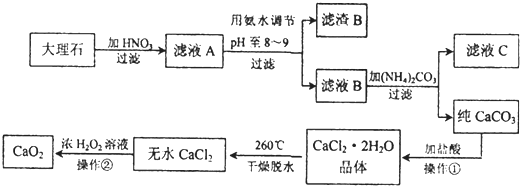
题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
考点:阿伏加德罗常数
专题:
分析:A、氢氧化铝胶体微粒是氢氧化铝的集合体;
B、依据n=
计算物质的量,结合乙烯结构分析计算极性共价键数;
C、浓硫酸随反应进行浓度减小变为稀硫酸不与铜发生反应;
D、氯气全部反应,依据反应的氯气计算电子转移.
B、依据n=
| m |
| M |
C、浓硫酸随反应进行浓度减小变为稀硫酸不与铜发生反应;
D、氯气全部反应,依据反应的氯气计算电子转移.
解答:
解:A、氢氧化铝胶体微粒是氢氧化铝的集合体,0.1molAlCl3完全水解转化为氢氧化铝胶体,生成胶粒小于0.1NA个,故A错误;
B、依据n=
计算物质的量=
=1mol,结合乙烯结构分析计算极性共价键数=1mol×4×NA=4NA,故B错误;
C、浓硫酸随反应进行浓度减小变为稀硫酸不与铜发生反应,100mL18mol/L浓硫酸溶液中溶质物质的量为0.8mol,与足量的铜反应,生成SO2的分子数小于0.9NA,故C正确;
D、氯气全部反应,依据反应的氯气计算电子转移,足量的铁与0.1molC12充分反应,转移的电子数为0.2NA,故D错误;
故选C.
B、依据n=
| m |
| M |
| 28g |
| 28g/mol |
C、浓硫酸随反应进行浓度减小变为稀硫酸不与铜发生反应,100mL18mol/L浓硫酸溶液中溶质物质的量为0.8mol,与足量的铜反应,生成SO2的分子数小于0.9NA,故C正确;
D、氯气全部反应,依据反应的氯气计算电子转移,足量的铁与0.1molC12充分反应,转移的电子数为0.2NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是胶体微粒结构,物质结构的分析判断,注意浓硫酸变稀后不与铜发生反应,题目较简单.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列物质属于电解质的是( )
| A、铜 |
| B、AgNO3 |
| C、蔗糖 |
| D、硫酸 |
下列说法中正确的是( )
| A、把100 mL 3 mol?L-1的H2SO4溶液跟100 mL H2O混合,硫酸的物质的量浓度变为1.5 mol?L-1 |
| B、把200 mL 3 mol?L-1的BaCl2溶液跟100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是 3 mol?L-1 |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% |
我国是世界上严重缺碘的地区,全国有约四亿多人缺碘,因此我国政府规定:国内销售的食盐必须加碘,食盐中加的碘是什么物质( )
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A、已知N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变变为△H=46.2kJ/mol |
| B、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| C、室温下pH=13的NaOH溶液中含有的OH-0.1 NA |
| D、浓度分别为1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa 混合液共1L,含CH3COOH 和 CH3COO-共1.5 mol |
下列说法中正确的是( )
| A、H2SO4 的摩尔质量是 98 g |
| B、1 mol H2O的质量是 18 g/mol |
| C、Cl-的摩尔质量是 35.5 g/mol |
| D、1 mol H2O中含有2 mol H和1 mol O |
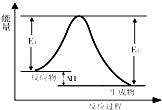 关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )
关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D、降低反应体系温度,反应速率减慢,A的转化率增大 |