题目内容
15.写出下列化学方程式对应的离子方程式.(1)铝和盐酸的反应2Al3++6H+=2Al3++3H2↑
(2)铝和氢氧化钠的反应2Al+2H2O+2OH-═2AlO2-+3H2↑.
分析 (1)铝与盐酸反应生成氯化铝和 氢气;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)铝与盐酸反应生成氯化铝和氢气,离子方程式:2Al3++6H+=2Al3++3H2↑;
故答案为:2Al3++6H+=2Al3++3H2↑;
(2)铝和氢氧化钠的反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑.
点评 本题考查了离子方程式的书写,明确反应实质及离子反应方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律.

练习册系列答案
相关题目
5.在150°C时,加热高氯酸铵固体发生分解反应:2NH4ClO4=N2+Cl2+2O2+4H2O,其气态生成物组成的混合气的平均式量为( )
| A. | 40.75 | B. | 29.38 | C. | 14.69 | D. | 无法计算 |
6.化学反应常伴随着颜色变化,下列现象描述不正确的是( )
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 湿润的淀粉碘化钾试纸遇氯气变蓝色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
3.现有室温下四种溶液,有关叙述不正确的是( )
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va:Vb=9:11 |
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 盐酸 | D. | CuSO4溶液 |
20.下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )


| A. | ①②③ | B. | ①③⑤ | C. | ②④ | D. | ②③④ |
4.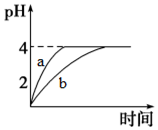 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1<m2(选填“<”、“=”或“>”).
(2)25℃时,向水的电离平衡体系中加入适量碳酸钠固体,其水解方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,测得溶液的pH=12,则由水电离出的c(OH-)=0.01mol•L-1.
(3)生活中常用用醋酸除去水垢(主要成分CaCO3),请从平衡角度解释原因:碳酸钙存在沉淀溶解平衡,CaCO3(s)?Ca2+(aq)+CO32-(aq),醋酸为弱酸存在电离平衡,CH3COOH?CH3COO-+H+,氢离子结合碳酸根离子促进程度溶解平衡正向进行,碳酸钙溶解.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
①在常温下,相同物质的量浓度的a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液三种溶液的pH由小到大的顺序为c<a<b(用序号回答).
②向NaCN溶液中通入少量的CO2,发生反应的离子方程式为CO2+H2O+CN-=HCO3-+HCN.
③25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1<m2(选填“<”、“=”或“>”).
(2)25℃时,向水的电离平衡体系中加入适量碳酸钠固体,其水解方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,测得溶液的pH=12,则由水电离出的c(OH-)=0.01mol•L-1.
(3)生活中常用用醋酸除去水垢(主要成分CaCO3),请从平衡角度解释原因:碳酸钙存在沉淀溶解平衡,CaCO3(s)?Ca2+(aq)+CO32-(aq),醋酸为弱酸存在电离平衡,CH3COOH?CH3COO-+H+,氢离子结合碳酸根离子促进程度溶解平衡正向进行,碳酸钙溶解.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的离子方程式为CO2+H2O+CN-=HCO3-+HCN.
③25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
 判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).
判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).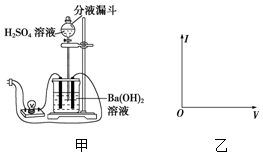 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题: