题目内容
12.25℃时,关于下列溶液的叙述正确的是( )| A. | 常温下,0.1mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的NH4Cl溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度 | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 将a mol•L-1 CH3COOH溶液与b mol•L-1 NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
分析 A、任何电解质溶液中都存在质子守恒;
B、氯化铵水解促进水的电离,一水合氨抑制水的电离;
C、Ka越小,对应盐的水解程度越大,其离子总数就小,结合溶液中电荷守恒分析判断;
D、等物质的量的醋酸和氢氧化钠反应后的溶液显碱性,据此分析.
解答 解:A、任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B、pH=3的NH4Cl溶液中由水电离出来的氢离子浓度为10-3mol/L,pH=11的氨水溶液中由水电离出来的氢离子浓度为10-11mol/L,故B错误;
C.Ka越小,对应盐的水解程度越大,由c(Na+)+c(H+)=c(OH-)+c(ClO-)、c(Na+)+c(H+)=c(OH-)+c(CN-),NaCN溶液c(H+)小,则等体积等浓度的NaClO、NaCN溶液中,前者离子总数大于后者,故C错误;
D、等物质的量的醋酸和氢氧化钠反应生成醋酸钠为强碱弱酸盐,水解显碱性,a mol•L-1 CH3COOH溶液与b mol•L-1 NaOH溶液等体积混合,测得溶液pH为7,说明醋酸的物质的量大于氢氧化钠,故D正确;
故选D.
点评 本题考查了电解质溶液中酸碱反应、盐类水解、弱电解质电离平衡、电解质溶液中电荷守恒、物料守恒等知识点,题目难度不大.

练习册系列答案
相关题目
18.X、Y、Z、W四种气体都是污染大气的物质,其中Y跟W按一定体积比相遇时可消除气体的毒性;Y跟Z相遇时,可使气体的红棕色变浅;Y与Z分别是引起酸雨的主要物质,这四种气体依次是( )
| A. | H2S、NO、HCl、SO2 | B. | SO2、HCl、NO2、H2S | C. | H2S、NO2、Cl2、SO2 | D. | Cl2、SO2、NO2、H2S |
3.下列离子方程式正确的是( )
| A. | 澄清的石灰水与盐酸反应 Ca(OH)2+2H+═Ca2++2H2 O | |
| B. | 钠与水的反应 Na+2H2 O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液 Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸 CaCO3+2 CH3COOH═Ca2++2 CH3COO-+H2O+CO2↑ |
7.下列叙述正确的是( )
| A. | 1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L | |
| D. | 配制1 L 0.2 mol/L的CuSO4溶液,需用25 g胆矾 |
17.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验事实的解释正确的是( )
| 现象 | 解释 | |
| A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| B | SO2使酸性高锰酸钾溶液褪色 | SO2具有漂白性 |
| C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验操作或装置能达到实验目的是( )
| A. |  量取109.3mL稀盐酸 | B. |  称量25g烧碱固体 | ||
| C. |  碳酸氢钠受热分解 | D. | 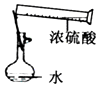 配制一定物质的量浓度的稀硫酸 |
1.下列离子方程式书写正确的是( )
| A. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3腐蚀电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向Mg(OH)2中加入盐酸:OH-+H+═H2O | |
| D. | Cl2与水反应:Cl2+H2O═2H++Cl-+ClO- |
2.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | FeS+稀H2SO4 | B. | NaOH+FeCl3 | C. | Cl2+NaOH溶液 | D. | SO2+NaOH |