题目内容
17.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验事实的解释正确的是( )| 现象 | 解释 | |
| A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| B | SO2使酸性高锰酸钾溶液褪色 | SO2具有漂白性 |
| C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠元素的黄色火焰可以覆盖钾元素的紫色火焰;
B.二氧化硫与酸性高锰酸钾溶液发生氧化还原反应,证明二氧化硫具有还原性;
C.加入盐酸排除了干扰离子,再加入氯化钡溶液,生成的白色沉淀为硫酸钡,据此可证明原溶液中含有硫酸根离子;
D.铁与稀硝酸反应生成硝酸铁(或硝酸亚铁)、NO气体和水,不是置换反应.
解答 解:A.钠元素的黄色火焰可以覆盖钾元素的紫色火焰,用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+,可能有K+,故A错误;
B.SO2使酸性KMnO4溶液褪色,发生氧化还原反应,与二氧化硫的还原性有关,没有表现漂白性,故B错误;
C.某溶液中先加入稀盐酸无现象,排除了干扰离子,再加入氯化钡溶液,生成的白色沉淀为硫酸钡,则该溶液中一定含有SO42-,故C正确;
D.铁加入稀硝酸中有气泡产生,生成的气体为NO,二者反应生成硝酸铁(或硝酸亚铁)、NO气体和水,该反应不属于置换反应,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及焰色反应、二氧化硫性质、离子检验、反应类型判断等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列化学用语错误的是( )
| A. | 氨分子的结构式: | B. | 氮气的结构式: | ||
| C. | 氯离子的结构示意图: | D. | 氨分子的比例模型: |
8.把蘸有浓盐酸的玻璃棒靠近装有氨水的试剂瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的( )
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①③⑥ |
12.25℃时,关于下列溶液的叙述正确的是( )
| A. | 常温下,0.1mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的NH4Cl溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度 | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 将a mol•L-1 CH3COOH溶液与b mol•L-1 NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
2.有四种微粒的结构示意图如图,下列说法错误的是( )
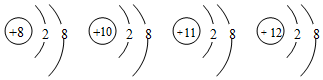
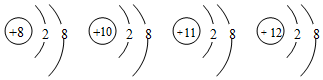
| A. | 它们属于不同种元素 | |
| B. | 它们的核外电子排布相同 | |
| C. | 它们都是离子 | |
| D. | 它们都具有稀有气体原子的稳定结构 |
9.下列说法正确的是( )
| A. | 实验室制取乙酸乙酯时,往大试管中依次加入浓硫酸、无水乙醇、冰醋酸 | |
| B. | 检验C2H5Cl中含Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化,再滴入硝酸银溶液 | |
| C. | 银氨溶液的配制:向洁净的试管里加入1mL2%的稀氨水,边振荡边滴加2%的AgNO3 溶液 | |
| D. | 实验室制得的粗溴苯通常呈黄色,是因为溶解了少量的Br2 |
6.当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是( )
| A. | 钠和氧气 | B. | 锌和硫酸 | ||
| C. | 氢氧化钠和二氧化碳 | D. | 氢气和氯气 |
7.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH溶液的反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液的反应:SO32-+2H+═SO2↑+H2O |