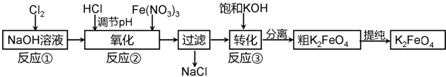
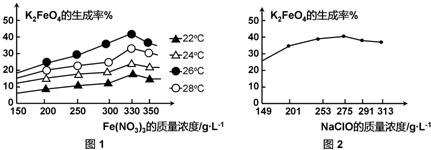
题目内容
下列说法错误的是( )
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
考点:焓变和熵变
专题:
分析:A.同种物质固体的熵小于液体时的熵;
B.熵表示物质的混乱度;
C.放热反应不一定是自发过程;
D.△G=△H-T△S<0,反应自发进行.
B.熵表示物质的混乱度;
C.放热反应不一定是自发过程;
D.△G=△H-T△S<0,反应自发进行.
解答:
解:A.同种物质固体的熵小于液体时的熵,NH4NO3溶于水是熵增大的过程,NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加,故A正确;
B.熵表示物质的混乱度,物质混乱度越大,则熵越大,所以同一种物质气态时熵值最大,液态时次之,而固态时熵值最小,故B正确;
C.不借助于外力而自发进行的过程,其体系的能量不一定是由高能状态转变为低能状态,放热反应不一定是自发过程,要根据体系的焓变和熵变综合考虑,故C错误;
D.△G=△H-T△S<0,反应自发进行,所以要判断反应进行的方向,必须综合考虑体系的焓变和熵变,故D正确.
故选C.
B.熵表示物质的混乱度,物质混乱度越大,则熵越大,所以同一种物质气态时熵值最大,液态时次之,而固态时熵值最小,故B正确;
C.不借助于外力而自发进行的过程,其体系的能量不一定是由高能状态转变为低能状态,放热反应不一定是自发过程,要根据体系的焓变和熵变综合考虑,故C错误;
D.△G=△H-T△S<0,反应自发进行,所以要判断反应进行的方向,必须综合考虑体系的焓变和熵变,故D正确.
故选C.
点评:本题考查了熵变、焓变、和反应自发性的判断,题目难度不大,注意根据△G=△H-T△S判断反应能否自发进行.

练习册系列答案
相关题目
向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示.乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.则下列说法不正确的是( )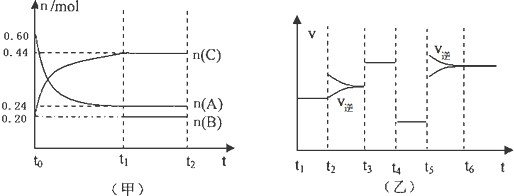

| A、若t1=15s,则t0-t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L?s) |
| B、B的起始物质的量为0.08mol |
| C、若t2-t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变大 |
| D、该反应为放热反应 |
下列关于蛋白质在人体中的新陈代谢的认识不正确的是( )
| A、蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量石膏能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、鉴别某纺织物成分是蛋白丝还是人造丝,可采用灼烧闻气味的方法 |
一定量某营养液中溶质的配方分别如下:对于两种营养液的成分,下列说法中正确的是( )
配方一:0.3mol KCl,0.2mol K2SO4,0.1molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
配方一:0.3mol KCl,0.2mol K2SO4,0.1molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量完全不同 |
| D、完全相同 |
在Na2S溶液中下列关系不正确的是( )
| A、c(Na+)=2c( HS-)+2c(S2-)+2c(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
| A、已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |||
| D、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |