题目内容
(1)常温下,将0.2mol/L HCl溶液与0.2mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) .
(2)混合后溶液中由水电离出的c(OH-)为
(3)常温下,将0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A、[Cl-]>[NH4+]>[H+]>[OH-]
B、[NH4+]>[Cl-]>[OH-]>[H+]
C、[Cl-]=[NH4+]>[H+]=[OH-]
D、[NH4+]>[Cl-]>[H+]>[OH-]
(4)由电离常数可知酸性强弱:CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为: (填序号)
①CH3COONa ②NaHCO3 ③Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是 .
(6)Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20.在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 .
(1)混合后溶液呈酸性的原因是(用离子方程式回答)
(2)混合后溶液中由水电离出的c(OH-)为
(3)常温下,将0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A、[Cl-]>[NH4+]>[H+]>[OH-]
B、[NH4+]>[Cl-]>[OH-]>[H+]
C、[Cl-]=[NH4+]>[H+]=[OH-]
D、[NH4+]>[Cl-]>[H+]>[OH-]
(4)由电离常数可知酸性强弱:CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为:
①CH3COONa ②NaHCO3 ③Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是
(6)Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20.在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡,盐类水解的原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)氯化铵中铵根离子水解显示酸性,据此回答;
(2)由水电离出的c(OH-)和c(H+)是相等的;
(3)0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,则c(H+)=c(OH-),根据电荷守恒判断;
(4)根据盐的水解规律:越弱越水解结合物质中水解的原理来回答;
(5)氯化铁溶液中铁离子水解,同时得到挥发性的酸HCl;
(6)根据沉淀溶度积Ksp=c(Cu2+)?c2(OH-)来计算回答.
(2)由水电离出的c(OH-)和c(H+)是相等的;
(3)0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,则c(H+)=c(OH-),根据电荷守恒判断;
(4)根据盐的水解规律:越弱越水解结合物质中水解的原理来回答;
(5)氯化铁溶液中铁离子水解,同时得到挥发性的酸HCl;
(6)根据沉淀溶度积Ksp=c(Cu2+)?c2(OH-)来计算回答.
解答:
解:(1)①将0.2mol/L HCl溶液与0.2mol/L氨水等体积混合(忽略混合后溶液体积的变化)得到氯化铵溶液,铵根离子水解,显示酸性,混合后溶液的pH=6,
故答案为:NH4++H2O?NH3?H2O+H+;
(2)水的离子积表达式Kw=c(H+)?c(OH-),混合后溶液pH=6,所有的氢离子据来自水的电离,由水电离出的c(OH-)和c(H+)是相等的,即为10-6mol/L,
故答案为:10-6mol/L;
(3)0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,则c(H+)=c(OH-),根据电荷守恒:[Cl-]+[OH-]=[NH4+]+[H+],所以:[Cl-]=[NH4+]>[H+]=[OH-],故答案为:C;
(4)由电离常数可知酸性强弱:CH3COOH>H2CO3>HCO3-,所以水解程度:碳酸根离子>碳酸氢根>醋酸根离子,所以①CH3COONa ②NaHCO3 ③Na2CO3的碱性顺序是:
③>②>①,故答案为:③>②>①;
(5)氯化铁溶液中铁离子水解生成氢氧化铁同时得到挥发性的酸HCl,加热促进水解右移,氢氧化铁受热得到氧化铁,故答案为:氧化铁;
(6)向0.02mol?L-1的CuSO4溶液中加入NaOH溶液,形成氢氧化铜沉淀,根据沉淀溶度积Ksp=c(Cu2+)?c2(OH-),则c(OH-)=
=
=10-9mol/L,所以c(H+)=10-5mol/L,pH=5,故答案为:5.
故答案为:NH4++H2O?NH3?H2O+H+;
(2)水的离子积表达式Kw=c(H+)?c(OH-),混合后溶液pH=6,所有的氢离子据来自水的电离,由水电离出的c(OH-)和c(H+)是相等的,即为10-6mol/L,
故答案为:10-6mol/L;
(3)0.2mol?L-1的盐酸与 0.2mol?L-1的氨水混合,若所得的混合溶液中的pH=7,则c(H+)=c(OH-),根据电荷守恒:[Cl-]+[OH-]=[NH4+]+[H+],所以:[Cl-]=[NH4+]>[H+]=[OH-],故答案为:C;
(4)由电离常数可知酸性强弱:CH3COOH>H2CO3>HCO3-,所以水解程度:碳酸根离子>碳酸氢根>醋酸根离子,所以①CH3COONa ②NaHCO3 ③Na2CO3的碱性顺序是:
③>②>①,故答案为:③>②>①;
(5)氯化铁溶液中铁离子水解生成氢氧化铁同时得到挥发性的酸HCl,加热促进水解右移,氢氧化铁受热得到氧化铁,故答案为:氧化铁;
(6)向0.02mol?L-1的CuSO4溶液中加入NaOH溶液,形成氢氧化铜沉淀,根据沉淀溶度积Ksp=c(Cu2+)?c2(OH-),则c(OH-)=
|
|
点评:本题考查学生弱电解质的电离以及盐的水解规律以及应用等知识,属于综合知识的考查,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
尿素是一种重要的氮肥,其合成反应为:2NH3(l)+CO2(g)?CO(NH2)2(l)+H2O(l)△H=-103.7kJ?mol-1影响尿素合成反应平衡的主要因素有温度、压力、氨碳比[n(NH3)/n(CO2)]、水碳比[n(H2O)/n(CO2)]等因素,下列说法正确的是( )
| A、升高温度能加快生成尿素的速率 |
| B、增大压强能使反应有利于向生物方向移动 |
| C、氨碳比越大越有利于尿素的生成 |
| D、若氨能与反应生成的水结合生成一水合氨,则能促使平衡向生成尿素方向移动 |
下列说法错误的是( )
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
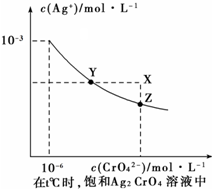 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
化学与生产、生活、环境密切相关.下列说法错误的是( )
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、水泥、陶瓷均为硅酸盐产品 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| D、化学反应能够制造出新的物质,同时也能制造出新的元素 |
下列反应中,划线的物质是还原剂的是( )
| A、CO2+ NaOH=NaHCO3 | ||||
B、Fe2O3+3H2
| ||||
| C、Cu+2 FeCl3=2FeCl2+Cu | ||||
| D、2F2+2H2O=4HF+O2 |