题目内容
下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
| A、已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |||
| D、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
考点:反应热和焓变,反应热的大小比较
专题:
分析:A、C完全燃烧放热多,放热越多△H越小;
B、合成氨是可逆反应,反应物不能完全转化;
C、20.0gNaOH是0.5mol,其反应放热28.7KJ,则1molNaOH反应放热57.4KJ;
D、燃烧热是指H生成液态水时放热多少.
B、合成氨是可逆反应,反应物不能完全转化;
C、20.0gNaOH是0.5mol,其反应放热28.7KJ,则1molNaOH反应放热57.4KJ;
D、燃烧热是指H生成液态水时放热多少.
解答:
解:A、C完全燃烧放热多,放热越多△H越小,所以△H1<△H2,故A正确;
B、合成氨是可逆反应,反应物0.5mol N2和1.5molH2不能完全转化,而热化学方程式中是指完全转化是的能量变化,故B错误;
C、20.0gNaOH是0.5mol,其稀溶液与稀盐酸反应放热28.7KJ,则含1molNaOH的稀溶液与稀盐酸反应放热57.4KJ,故C正确;
D、燃烧热是指生成稳定化合物时放热多少,H生成液态水,故D错误;
故选AC.
B、合成氨是可逆反应,反应物0.5mol N2和1.5molH2不能完全转化,而热化学方程式中是指完全转化是的能量变化,故B错误;
C、20.0gNaOH是0.5mol,其稀溶液与稀盐酸反应放热28.7KJ,则含1molNaOH的稀溶液与稀盐酸反应放热57.4KJ,故C正确;
D、燃烧热是指生成稳定化合物时放热多少,H生成液态水,故D错误;
故选AC.
点评:本题考查了C完全燃烧放热多、可逆反应的焓变、中和热、燃烧热,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列说法错误的是( )
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
下列有关化学用语使用正确的是( )
A、HClO的电子式: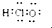 | ||
B、Mg2+的结构示意图: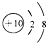 | ||
| C、乙酸乙酯的结构简式:CH3COOCCH3 | ||
D、具有16个质子,16个中子和18个电子的单核离子是
|
下列反应中,划线的物质是还原剂的是( )
| A、CO2+ NaOH=NaHCO3 | ||||
B、Fe2O3+3H2
| ||||
| C、Cu+2 FeCl3=2FeCl2+Cu | ||||
| D、2F2+2H2O=4HF+O2 |
已知在相同条件下进行下列反应:下列说法正确的是( )
①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3.
①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3.
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、反应①和反应③中均生成Br2,溴元素发生的变化相同 |
| C、反应②中被氧化与被还原物质的物质的量之比为6:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为10mol |
等质量的O2和O3中( )
| A、所含原子数相同 |
| B、所含分子数相同 |
| C、同温同压下,气体体积相同 |
| D、同温同压下,气体的密度相同 |
下列反应中不属于基本反应类型的是( )
| A、Cl2+H2O═HCl+HClO |
| B、Zn+H2SO4═ZnSO4+H2↑ |
| C、Na2O+H2O═2NaOH |
| D、NaCl+AgNO3═AgCl↓+NaNO3 |