题目内容
在Na2S溶液中下列关系不正确的是( )
| A、c(Na+)=2c( HS-)+2c(S2-)+2c(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
考点:离子浓度大小的比较
专题:
分析:A.硫化钠溶液中一定满足物料守恒,根据物料守恒解答;
B.硫化钠溶液中遵循电荷守恒,根据溶液中电荷守恒分析;
C.硫离子在溶液中部分水解生成硫氢根离子和氢氧根离子,氢氧根离子来自水的电离及硫离子水解,则c(OH-)>c(HS-);
D.根据硫化钠溶液中电荷守恒、物料守恒判断.
B.硫化钠溶液中遵循电荷守恒,根据溶液中电荷守恒分析;
C.硫离子在溶液中部分水解生成硫氢根离子和氢氧根离子,氢氧根离子来自水的电离及硫离子水解,则c(OH-)>c(HS-);
D.根据硫化钠溶液中电荷守恒、物料守恒判断.
解答:
解:A.根据硫化钠溶液中的物料守恒得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),故A正确;
B.溶液中存在电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故B正确;
C.硫离子和硫氢根离子水解都生成氢氧根离子,溶液显示碱性,只有硫离子水解生成硫氢根离子,但硫离子水解程度较小,所以溶液中存离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-),故C正确;
D.溶液中存在物料守恒c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故D错误;
故选D.
B.溶液中存在电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故B正确;
C.硫离子和硫氢根离子水解都生成氢氧根离子,溶液显示碱性,只有硫离子水解生成硫氢根离子,但硫离子水解程度较小,所以溶液中存离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-),故C正确;
D.溶液中存在物料守恒c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故D错误;
故选D.
点评:本题考查了离子浓度大小比较,题目难度中等,根据溶液的酸碱性再结合电荷守恒、物料守恒分析解答,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列实验装置或操作与粒子的大小有直接关系的是( )
A、 蒸馏 |
B、 蒸发 |
C、 萃取 |
D、 丁达尔效应 |
下列说法错误的是( )
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
下列有机物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
①CH3Cl② ③
③ ④
④
①CH3Cl②
 ③
③ ④
④
| A、①② | B、②③④ |
| C、② | D、①②③④ |
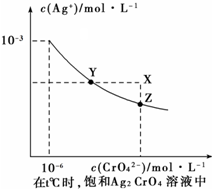 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
民以食为天,下列关于厨房调味品的说法正确的是( )
| A、食醋和料酒的主要成分都是有机酸 |
| B、食盐和味精的成分中都含有钠离子 |
| C、蔗糖和小苏打都是可溶于水的电解质 |
| D、食用油和人造奶油都不能与溴水发生加成反应 |
已知在相同条件下进行下列反应:下列说法正确的是( )
①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3.
①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3.
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、反应①和反应③中均生成Br2,溴元素发生的变化相同 |
| C、反应②中被氧化与被还原物质的物质的量之比为6:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为10mol |