题目内容
高铁酸钾是一种新型高效多功能水处理剂.工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
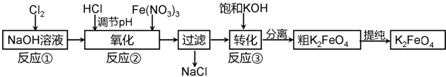
(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量.实验室用pH试纸测定溶液pH的操作是 .
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”).
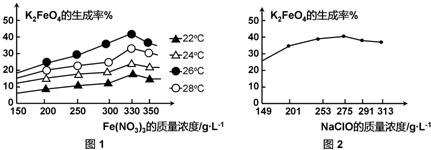
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 .
(4)K2FeO4在水溶液中易“水解”:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号).
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质.根据污染物的实际情况向水中加入适量的K2FeO4将污染物转化为无污染的物质,试写出K2FeO4处理含有NH3污水时与NH3反应的离子方程式 .
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:

(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量.实验室用pH试纸测定溶液pH的操作是
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
工业生产中最佳温度为

(4)K2FeO4在水溶液中易“水解”:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质.根据污染物的实际情况向水中加入适量的K2FeO4将污染物转化为无污染的物质,试写出K2FeO4处理含有NH3污水时与NH3反应的离子方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,发生反应Na2FeO4+2KOH=K2FeO4+2NaOH,分离得到粗的K2FeO4,通过提纯得到纯的K2FeO4,
(1)用pH试纸测定溶液pH的方法是:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在PH试纸上,再与标准比色卡对照;
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4;
(3)Fe(NO3)3浓度一定,K2FeO4的生成率最高时的温度为最佳温度;
由图1可知,Fe(NO3)3浓度在375g/L时,K2FeO4的生成率最高,由图2可知,NaClO在255g/L时,K2FeO4的生成率最高,据此计算Fe(NO3)3与NaClO两种溶液最佳质量浓度之比;
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤;
(5)由题目信息可知,K2FeO4处理含有NH3污水时生成Fe(OH)3胶体,根据电子转移守恒可知,生成无污染的物质为氮气,由电荷守恒可知,还生成KOH.
(1)用pH试纸测定溶液pH的方法是:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在PH试纸上,再与标准比色卡对照;
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4;
(3)Fe(NO3)3浓度一定,K2FeO4的生成率最高时的温度为最佳温度;
由图1可知,Fe(NO3)3浓度在375g/L时,K2FeO4的生成率最高,由图2可知,NaClO在255g/L时,K2FeO4的生成率最高,据此计算Fe(NO3)3与NaClO两种溶液最佳质量浓度之比;
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤;
(5)由题目信息可知,K2FeO4处理含有NH3污水时生成Fe(OH)3胶体,根据电子转移守恒可知,生成无污染的物质为氮气,由电荷守恒可知,还生成KOH.
解答:
解:向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,发生反应Na2FeO4+2KOH=K2FeO4+2NaOH,分离得到粗的K2FeO4,通过提纯得到纯的K2FeO4,
(1)用pH试纸测定溶液pH的方法是:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在PH试纸上,再与标准比色卡对照;
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4,二者结构类型相同,所以Ksp(K2FeO4)<Ksp(Na2FeO4),
故答案为:<;
(3)由图1可知,Fe(NO3)3浓度一定,温度在26℃时,K2FeO4的生成率最高,故工业生产中最佳温度为26℃;
由图1可知,Fe(NO3)3浓度在330g/L时,K2FeO4的生成率最高,由图2可知,NaClO在275g/L时,K2FeO4的生成率最高,所以Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为330g/L:275g/L=6:5,
故答案为:26;6:5;
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤.
A.K2FeO4在水溶液中易“水解”:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,且容易损失,不能用水洗,故A错误;
B.CH3COONa、异丙醇,能抑制水解,减少洗涤损失,故B正确;
C.NH4Cl不能抑制水解,促进水解,故C错误;
D.Fe(NO3)3不能抑制水解,促进水解,故D错误,
故选:B;
(5)由题目信息可知,K2FeO4处理含有NH3污水时生成Fe(OH)3胶体,根据电子转移守恒可知,生成无污染的物质为氮气,由电荷守恒可知,还生成KOH,反应离子方程式为:2FeO42-+2NH3?H2O=2Fe(OH)3(胶体)+N2↑+4OH-,
故答案为:2FeO42-+2NH3?H2O=2Fe(OH)3(胶体)+N2↑+4OH-.
(1)用pH试纸测定溶液pH的方法是:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:取一小块试纸在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在PH试纸上,再与标准比色卡对照;
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,说明此温度下K2FeO4的溶解度小于Na2FeO4,二者结构类型相同,所以Ksp(K2FeO4)<Ksp(Na2FeO4),
故答案为:<;
(3)由图1可知,Fe(NO3)3浓度一定,温度在26℃时,K2FeO4的生成率最高,故工业生产中最佳温度为26℃;
由图1可知,Fe(NO3)3浓度在330g/L时,K2FeO4的生成率最高,由图2可知,NaClO在275g/L时,K2FeO4的生成率最高,所以Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为330g/L:275g/L=6:5,
故答案为:26;6:5;
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤.
A.K2FeO4在水溶液中易“水解”:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,且容易损失,不能用水洗,故A错误;
B.CH3COONa、异丙醇,能抑制水解,减少洗涤损失,故B正确;
C.NH4Cl不能抑制水解,促进水解,故C错误;
D.Fe(NO3)3不能抑制水解,促进水解,故D错误,
故选:B;
(5)由题目信息可知,K2FeO4处理含有NH3污水时生成Fe(OH)3胶体,根据电子转移守恒可知,生成无污染的物质为氮气,由电荷守恒可知,还生成KOH,反应离子方程式为:2FeO42-+2NH3?H2O=2Fe(OH)3(胶体)+N2↑+4OH-,
故答案为:2FeO42-+2NH3?H2O=2Fe(OH)3(胶体)+N2↑+4OH-.
点评:本题考查混合物的分离和提纯,涉及pH的测定、难溶物溶解平衡、离子反应等知识点,明确物质性质是解本题关键,同时考查学生对元素化合物知识的掌握、分析问题及基本操作能力,难点是图象分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验装置或操作与粒子的大小有直接关系的是( )
A、 蒸馏 |
B、 蒸发 |
C、 萃取 |
D、 丁达尔效应 |
下列说法错误的是( )
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |