题目内容
19.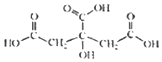 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | |
| B. | 柠檬酸是易溶于水的有机物 | |
| C. | 1mol柠檬酸足量的钠反应生成2.0mol的氢气 | |
| D. | 柠檬酸只能发生取代反应 |
分析 由结构可知分子式,分子中含3个-COOH,1个-OH,结合醇、羧酸的性质来解答.
解答 解:A.由结构可知柠檬酸的分子式是C6H8O7,故A正确;
B.含-OH、-COOH,与水形成氢键,易溶于水,故B正确;
C.含3个-COOH,1个-OH,均与Na反应生成氢气,则1mol柠檬酸足量的钠反应生成2.0mol的氢气,故C正确;
D.含-OH可发生取代、氧化、消去反应,含-OH、-COOH可发生缩聚反应,故D错误;
故选D.
点评 本题考查有机物的 结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意醇、羧酸的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.单质铁(Fe)可将水体中的硝酸盐(NO3-)转化为铵盐(NH4+)而去除掉,现将足量铁粉投入水体中,经24小时测定NO3-的去除率和初始pH的关系如图所示,已知pH=2.5时,在铁粉的外层包裹的主要是其氧化产物NO3-(可导电),而pH=4.5时,则是不导电的 FeO(OH),下列说法不正确的是( )
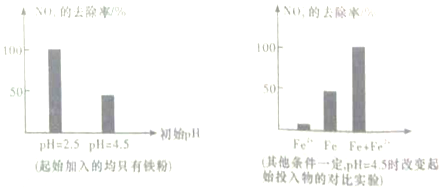

| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
10.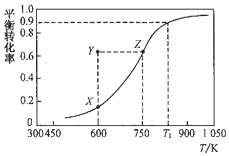 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )| A. | 平衡常数:K600K>K750K | |
| B. | 从Y到Z点可通过增大压强实现 | |
| C. | 在Tl点K时,该反应的平衡常数为8.1 | |
| D. | 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
7.已知电离常数的大小可以用来比较酸性的相对强弱,观察下表中的数据分析表格中两种弱酸可能涉及到的分子或离子,依据:较强酸+较弱酸盐=较弱酸+较强酸盐的反应规律,且较强酸和较弱酸盐按物质的量比为1:1发生反应,则最多可以写出的离子方程式的个数(不考虑难溶盐)是( )
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | Ka1=4.4×10-7 | H2C2O4 | Ka1=5.4×10-2 |
| Ka2=4.7×10-11 | Ka2=5.4×10-5 |
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
14.下列有关物质的俗称,正确的是( )
| A. | Fe2O3--铁红 | B. | SiO2--玛瑙 | C. | Na2SiO3水玻璃 | D. | NaHCO3--苏打 |
11.在实验室和生产生活中,安全是避免伤害和事故的保障.下列处理方法不正确的是( )
| A. | 金属钠着火时立即用沙子盖灭 | |
| B. | 制取有毒气体时需在通风橱中进行 | |
| C. | 将过期的化学药品直接倒入下水道 | |
| D. | 给试管中液体加热时试管口要避开人 |
11.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | Na、Mg、Al 的第一电离能逐渐增大 | B. | O、F、N 的电负性逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | 热稳定性:HF>H2O>NH3 |
