题目内容
10.电化学在金属冶炼和环境处理等方面有着广泛的应用
(1)由下列物质冶炼相应金属时采用电解法的是bd
a.Fe2O3b.NaCl c.Cu2S d.Al2O
(2)如图1为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,写出b电极反应式为Ag+e_=Ag+
(3)银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.黑色褪去的原因是(用电极反应是表示)Ag2S+2e-=2Ag+S2-,铝质容器为负极,其中食盐水的作用为增强导电性.
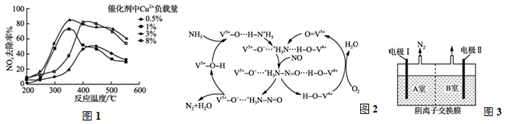
(4)利用电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-生成氮气的原理如图2所示.
①电源正极为A(填“A”或“B”),阴极反应式为2NO3-+6H2O+10e-=N2+12OH-.
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为7.2g.
分析 (1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;
(2)电解精炼时含有杂质的金属作阳极;阳极上是阴离子得电子的还原反应;
(3)铝、银和氯化钠溶液构成原电池,铝作负极、银作正极,负极上铝失电子发生氧化反应,正极上银离子得电子发生还原反应,据此分析解答;
(4)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有水参与反应;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室.
解答 解:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物,由于AlCl3是共价化合物熔融时不导电,所以Al是电解熔融的Al2O3制得;
故答案为:bd;
(2)电解精炼时,粗银作阳极,纯银作阴极,阳极与外接电源的正极相连,则a为含有杂质的粗银,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,b电极反应式为Ag+e_=Ag+,
故答案为:a;Ag+e_=Ag+;
(3)银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银,即Ag2S+2e-=2Ag+S2-,黑色褪去是Ag2S转化为Ag而不是AgCl,其中食盐水的作用为增强导电性,故答案为:Ag2S+2e-=2Ag+S2-; 负;为增强导电性;
(4)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应,所以阴极上发生的电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,故答案为:A;2NO3-+6H2O+10e-=N2+12OH-;
②转移1mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗0.5mol水,产生1molH+进入阴极室,阳极室质量减少9g;阴极室中放出0.1molN2(2.8g),同时有1molH+(1g)进入阴极室,因此阴极室质量减少1.8g,故膜两侧电解液的质量变化差(△m左-△m右)=9g-1.8g=7.2g,
故答案为:7.2.
点评 本题考查了电解原理的分析,电极分析判断方法,明确原电池工作原理为解答关键,注意掌握原电池两极的判断方法,能够正确书写电极反应式,试题培养了学生的灵活应用能力.

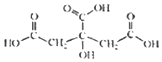 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | |
| B. | 柠檬酸是易溶于水的有机物 | |
| C. | 1mol柠檬酸足量的钠反应生成2.0mol的氢气 | |
| D. | 柠檬酸只能发生取代反应 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色 | 原溶液中有I- |
| B | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 稀HNO3将Fe氧化为Fe2+ |
| C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 室温下,用pH试纸测得:0.1mo/L Na2SO3溶液的pH约为10;0.1mol/LNaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
| A | 向FeCl2溶液中滴入氯水2Fe2++Cl2=2Fe3++2C l- | 向FeC l2溶液中滴入碘水2Fe2++I2=2Fe3++2I- |
| B | 向澄清石灰水中通入少量CO2 气体Ca2++2OH-+CO2=CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体Ca2++2OH-+SO2=CaSO3↓+H2O |
| C | 向Na2CO3溶液中滴入稀HNO3CO32-+2H+=CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3SO32-+2H+=SO2↑+H2O |
| D | CO2 通入漂白粉溶液中CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO | SO2通入漂白粉溶液中SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )
A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )| A. | 原子半径大小:B>A>C | |
| B. | 气态时稳定性:乙>甲 | |
| C. | 与甲含相同元素的另一化合物既有极性键也有非极性键 | |
| D. | 等浓度时,乙的水溶液在A的同主族无氧酸中酸性最强 |
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
| C. | 达平衡后,缩小容器容积,v正和v逆都增大 | |
| D. | 增大SO2浓度,v正增大v逆减小 |
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素Y、W的简单离子具有相同的电子层结构 | |
| C. | Z的最高价氧化物对应水化物的酸性比X的强 | |
| D. | 由X与Y两种元素组成的简单化合物是离子化合物 |