题目内容
10.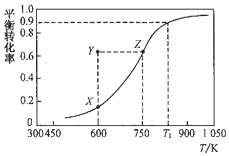 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )| A. | 平衡常数:K600K>K750K | |
| B. | 从Y到Z点可通过增大压强实现 | |
| C. | 在Tl点K时,该反应的平衡常数为8.1 | |
| D. | 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
分析 A、由甲醇的平衡转化率随温度变化的曲线图可知,温度越高,平衡越向正向移动;
B、增大压强,平衡向逆反应方向移动,甲醇转化率减小;
C、设甲醇的初始浓度为1mol/L,根据此时的转化率计算出甲醛和氢气的浓度,然后计算出该反应的在该温度下的平衡常数;
D、1050K以上,需要提供较多的能量,对设备要求也很高,而且转化率变化不大,不能提高综合经济效益.
解答 解:A、由甲醇的平衡转化率随温度变化的曲线图可知,温度越高,平衡越向正向移动,所以平衡常数越大,则平衡常数:K600K<K750K,故A错误;
B、由图可知Y点和Z点甲醇转化率相等,若增大压强,平衡向逆反应方向移动,甲醇转化率减小,则甲醇的转化率将小于Z点甲醇转化率,故B错误;
C、设甲醇的初始浓度为1mol/L,在t1K时甲醇的转化率为0.9,则平衡时甲醇消耗的浓度为:1mol/L×0.9=0.9mol/L,平衡时甲醇浓度为0.1mol/L,根据反应CH3OH(g)?HCHO(g)+H2(g)可知平衡时甲醛和氢气浓度相等,都是0.9mol/L,则在t1K时该反应的平衡常数K=$\frac{0.9×0.9}{0.1}$=8.1,故C正确;
D、1050K以上,需要提供较多的能量,对设备要求也很高,而且转化率变化不大,不能提高综合经济效益,故D错误.
故选:C.
点评 本题考查化学平衡影响因素、化学平衡常数及其计算等,从图中提取有用信息的能力尤为关键,难度中等,注意基础知识理解掌握.

练习册系列答案
相关题目
1.2016年12月,中共中央、国务院印发了《关于全面推行河长制的意见》,进一步加强水污染治理工作.下列做法不应该提倡的是( )
| A. | 用碱性废水中和处理酸性废水 | |
| B. | 将工业废液排入海洋以减少河道污染 | |
| C. | 生活污水无害化处理后用于绿化灌溉 | |
| D. | 推广使用高效、低毒农药,减轻水体污染 |
5.从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程.下列有关图示操作正确的是( )
| A. |  用装置甲将海带灼烧成灰 | B. |  用装置乙过滤得含I-的溶液 | ||
| C. |  用装置丙分离出碘的CCl4溶液 | D. |  用装置丁蒸馏获得碘并回收CCl4 |
15.装置甲、乙、丙中分别盛有空气、水、空气,两个燃烧匙中物质足量,燃烧完全后,打开止水夹,水倒吸到丙装置中.则燃烧匙a、b中盛有的物质分別是( )
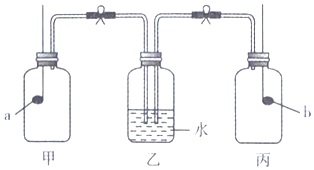

| A. | a为红磷,b为钠 | B. | a为硫,b为木炭 | C. | a为钠,b为红硫 | D. | a为木炭,b为磷 |
2.对反应A(s)+3B(g)?2C(g)+D(g)来说,下列反应速率最快的是( )
| A. | v(A)=0.02 mol/(L•s) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.5 mol/(L•min) | D. | v(D)=0.01 mol/(L•s) |
19.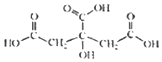 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | |
| B. | 柠檬酸是易溶于水的有机物 | |
| C. | 1mol柠檬酸足量的钠反应生成2.0mol的氢气 | |
| D. | 柠檬酸只能发生取代反应 |
2. 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
| C. | 达平衡后,缩小容器容积,v正和v逆都增大 | |
| D. | 增大SO2浓度,v正增大v逆减小 |
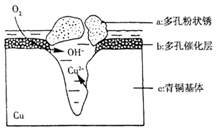 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.