题目内容
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.HA电离平衡常数与温度有关,与溶液的酸碱性无关;
B.通入氯化氢,根据电荷守恒c(Cl-)+c(A-)+c(OH-)=c(Na+)+c(H+)可知,钠离子浓度基本不变、氢离子浓度增大,阴离子浓度则增大;
C.a、b溶液呈酸性,抑制水的电离,c呈中性,以此判断水的电离程度大小;
D.b点时未加HCl和NaOH时,溶液呈酸性,说明HA的电离程度大于A-水解程度,据此判断c(HA)、c(A-)的浓度大小.
B.通入氯化氢,根据电荷守恒c(Cl-)+c(A-)+c(OH-)=c(Na+)+c(H+)可知,钠离子浓度基本不变、氢离子浓度增大,阴离子浓度则增大;
C.a、b溶液呈酸性,抑制水的电离,c呈中性,以此判断水的电离程度大小;
D.b点时未加HCl和NaOH时,溶液呈酸性,说明HA的电离程度大于A-水解程度,据此判断c(HA)、c(A-)的浓度大小.
解答:
解:A.电离平衡常数与温度有关,温度不变,电离平衡常数不变,所以加NaOH后,HA电离平衡常数不变,故A错误;
B.通入氯化氢,氯化氢为强电解质,溶液酸性增强,即氢离子浓度增大,根据电荷守恒c(Cl-)+c(A-)+c(OH-)=c(Na+)+c(H+)可知,溶液中钠离子浓度基本不变,而氢离子浓度增大,则阴离子的总浓度增大,故B错误;
C.a、b溶液呈酸性,抑制水的电离,c呈中性,pH越小,酸性越强,水的电离程度越小,则a、b、c三点所表示的溶液中水的电离程度依次增大,即:a<b<c,故C错误;
D.b点溶液中未加HCl和NaOH时,溶液呈酸性,c(OH-)<c(H+)说明HA的电离程度大于A-水解程度,则:c(A-)>c(HA),故D正确;
故选D.
B.通入氯化氢,氯化氢为强电解质,溶液酸性增强,即氢离子浓度增大,根据电荷守恒c(Cl-)+c(A-)+c(OH-)=c(Na+)+c(H+)可知,溶液中钠离子浓度基本不变,而氢离子浓度增大,则阴离子的总浓度增大,故B错误;
C.a、b溶液呈酸性,抑制水的电离,c呈中性,pH越小,酸性越强,水的电离程度越小,则a、b、c三点所表示的溶液中水的电离程度依次增大,即:a<b<c,故C错误;
D.b点溶液中未加HCl和NaOH时,溶液呈酸性,c(OH-)<c(H+)说明HA的电离程度大于A-水解程度,则:c(A-)>c(HA),故D正确;
故选D.
点评:本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列各项说法中,不正确的是( )
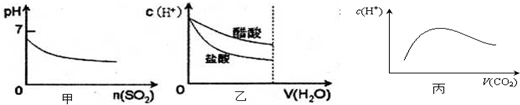

| A、甲是向溴水通入S02气体时,pH与S02物质的量的关系图 |
| B、乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C、常温常压下,将2b mol CO2气体通入1L b mol?L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2HgI4+2Cu.下列说法中正确的是( )
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
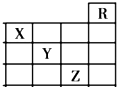 如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
③Z的单质常温下是液体,一定条件下可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
X、Y、Z、W、R 5种短周期元素,其原子序数依次增大.X是元素周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A、Z与Y两种元素组成的化合物中,阴、阳离子个数比为1:1或1:2 |
| B、Y、Z、W元素形成的简单离子具有相同电子层结构,其离子半径依次增大 |
| C、Z、R元素的氧化物的水化物之间相互反应生成的盐溶液呈中性、碱性或酸性 |
| D、Y、R元素分别与X元素形成的化合物的沸点:XmY<XmR |